某课外活动小组同学用如图装置进行实验,试回答下列问题: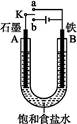
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。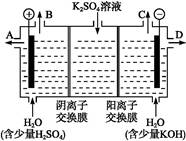
①该电解槽的阳极反应为 。
此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为 。
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图
计算
(1)a处沉淀的总物质的量mol
(2)c(FeCl3)=mol/L
(3)c(AlCl3)=mol/L
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-.将这四种溶液分别标记为A、B、C、D,进行实验:
①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收.试回答下列问题:
(1)D的化学式是________,判断理由是______________________________
(2)写出其余几种物质的化学式:A________,B________,C________.
(3)写出实验②中有关反应的离子方程式___________________________.
图中A-D是中学化学实验中常见的几种温度计装置示意图。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入A~C的横线中(多选要倒扣分)。
A B C .
①酒精和浓硫酸混合加热制乙烯 ②电石跟水反应制乙炔
③分离苯跟硝基苯的混合物 ④苯跟溴的取代反应
⑤石油分馏实验 ⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度 ⑧食盐和浓硫酸混合加热制氯化氢
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是:。
为探究氨的制取和性质,某兴趣小组的同学进行了如下实验。实验室制取氨气可以将浓氨水滴入生石灰中。装置如图所示。
(1)A中发生反应的化学方程式为;
(2)若要在C中收集满一瓶干燥的氨气,请在C装置中的虚线上描出导管实线图,B中应装入的试剂是;
(3)为吸收处理多余的氨气,可选择D、E、F装置中的装置;
(4)为探究氨气的还原性,他们往C装置中通入干燥氯气与氨气反应。
①若用二氧化锰与浓盐酸加热制取氯气,为得到干燥纯净的氯气,反应产生的氯气必须依次通过盛有、试剂的洗气瓶;
②C中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,反应的化学方程为;
③设计实验,检验C中生成的白烟中的阳离子。
( 7分) A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:
(1)固体A的晶体类型为___________,K的化学式为。
(2)C与D在高温下的反应在冶金工业上称为 反应。
(3)G→J的化学方程式为。
(4)A→H的离子方程式为。
(5)I的水溶液pH_____7(填“>”、“<”或“=”),原因是(用离子方程式表示)。