某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失;
④取溶液少许,滴人氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是___________(填代号)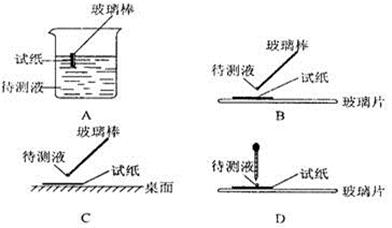
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是______________________。
(3)写出与②实验有关的离子方程式:
_____________________________________________________________
乙烯与乙烷混合气体共amol,与bmol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混和气体和45g水。
(1)当a=1时,乙烯和乙烷的物质的量的比是
(2)当a=1且反应后和混合气体的物质的量为反应前氧气的三分之二时,则b=; 得到的CO和CO2的物质的量之比是
(3)a的取值范围是
某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在该反应中,得电子的物质是______________ ,被氧化的元素是______________;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(4)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d. 在上市反应中,氧化性:SnCl2 >As还原性:H3AsO3>H2SnCl6
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干,焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为________________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是________________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。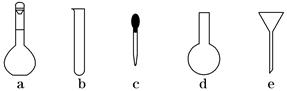
(4)滴定终点的现象是______________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”).
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。
下表为长式周期表的一部分,其中的编号代表对应的元素。试填空。
| ① |
|||||||||||||||||
| ② |
③ |
④ |
⑤ |
⑥ |
|||||||||||||
| ⑦ |
⑧ |
||||||||||||||||
| ⑨ |
⑩ |
(1)写出上表中元素⑨原子的外围电子排布式。
(2)元素③与⑧形成的化合物中元素③的杂化方式为:杂化,其形成的化合物的晶体类型是:________________。
(3)元素④、⑤的第一电离能大小顺序是:>(用元素符号表示);元素④与元素①形成的X分子的空间构型为:。请写出与N3—互为等电子体的分子或离子的化学式,(各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应的化学方程式。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:。
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。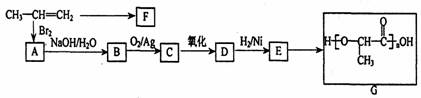
(1)聚合物F的结构简式是;
(2)D转化为E的化学方程式是;A转化为B的反应类型是。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是。
(4)写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
、、。