某pH=1的溶液X,其中可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取200mL溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。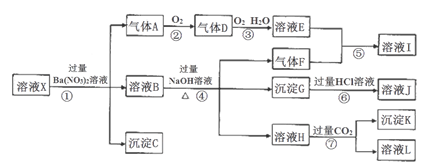
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有___________;
(2)溶液X中,关于NO3ˉ的判断一定正确的是______;
a.一定有 b.一定没有 c.可能有
(3)①中产生气体A的离子方程式为_________________;
(4)⑦中生成沉淀K的离子方程式为_______________;
(5)溶液X中不能确定的离子是________,若要用实验证明该离子一定不存在,其中最可靠的化学方法为_______________________;
(6)若实验测定A、F、K均为0.01mol,试确定沉淀C及其物质的量:_______________。
某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)
(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择(填“NaOH溶液”,“盐酸”,“FeCl3溶液”);步骤②的操作是,反应的离子方程式为,。
(2)固体Ⅲ的化学式为步骤④反应的化学方程式为。
(3)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果(填“偏高”“偏低”“不影响”)
2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是______。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO32-、SO42-、AlO2-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除__________的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除______的存在。
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液由酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除________的存在。
(4)取出部分(3)中的碱性溶液加入Na2CO3溶液,有白色沉淀生成,证明有________的存在,可以排除_____的存在。
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如图。
(1)柠檬酸的晶体类型为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为 (填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键B.极性键 C.非极性键
D.金属键E.氢键F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
(1)下面是利用氮气的一种途径
①步骤I中主要利用N2与液态空气中其它成分的________(填性质)不同。
②最新研究发现在碱性溶液中通过电解反应2N2+6H2O 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
(2)氨气可以用于侯氏制碱法,其流程如下图所示: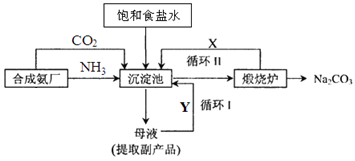
①循环I、II中循环利用的物质X是_________,Y是__________。(填化学式)
②向沉淀池中通入气体时,需要先通入NH3,再通入CO2,其原因是______________。