pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
(1)在人体血液中,HC 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,HC 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1、c(C )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
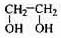
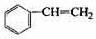

(甲) (乙) (丙) (丁)
填写下列空白:
(1)甲中官能团的名称是____________;
(2)淀粉通过下列转化可以得到乙(其中A—D均为有机物):
A的分子式是___________,试剂X可以是___________,B→C的反应类型___________。
完成下列转化的方程式:D→乙___________;甲在一定条件下加聚的方程式___________。
(3)已知: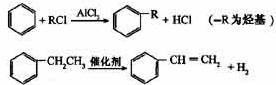
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是。
(4)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为。
下列实验操作正确的是
| A.向一支洁净的试管中加人2mL3%硝酸银溶液,再向试管中滴加氨水至产生的沉淀恰好溶解为止,加入乙醛溶液,水浴加热,片刻后将在试管内壁形成银镜。 |
| B.实验室制取乙烯时,必须将温度计的水银球插入反应液中。 |
| C.取2mL4mol/LNaOH溶液于试管中,加入2mL2mol/LCuSO4溶液,再加入某种有机试剂,加热,可根据是否产生红色沉淀判断该有机物中是否含有醛基。 |
| D.分离苯和苯酚的混合液,可向混合物中加人适量浓溴水,过滤、分液,即可实现。 |
E.用碱式滴定管量取12.00mLNaOH溶液。
F.无水乙醇与冰醋酸共热制取乙酸乙酯。
G.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤。
H.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硝酸酸化,再加入AgNO3溶液。
(4分)工业上用MnO2为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH、粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,两极发生的电极反应式:
阴极是,阳极是;
电解的总反应方程式是。
(8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为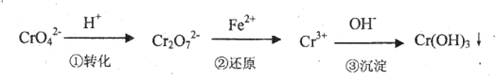
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色。
(2)能说明第①步反应达平衡状态的是。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有。
(5分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA;HA-?H++A2-回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是:——。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)==c(oH-)+c(HA-)+2c(A2-) D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能
是0.11 mol·L-1 (填“<”,“>”,或“=”),理由是: