进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
(3)污水中的亚汞离子(H )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。
氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:_ _____________。
_____________。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
| 试剂组合序号 |
固体试剂/g |
NH3体积/mL |
| a |
12.0g Ca(OH)2(过量) 10.8g NH4Cl |
2688 |
| b |
12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 (OH)2(过量) 10.8g(NH4)2SO4 |
2728 |
| c |
12.0g NaOH(过量) 10.8g NH4Cl |
3136 |
| d |
12.0g NaOH(过量) 10.8g (NH4)2SO4 |
3118 |
| e |
12.0g CaO(过量) 10.8g NH4Cl |
3506 |
| f |
12.0g CaO(过量) 10.8g (NH4)2SO4 |
3584 |
分析表中数据,实验室制NH3产率最高的是:___________________(填序号),其他组合NH3产率不高的原因是:____________。
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式:_________。
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是_____________。
③D装置中的液体可换成_________(填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是____ ____________。
____________。
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是;写出工业上制备B的化学反应方程式。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是,C所含共价键的类型和数目比为;反应③的化学方程式是。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都生成有颜色气体,B的结构式是,反应③的化学方程式是。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W元素在周期表中的位置为;写出Y元素原子的价电子排布式:;
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的分子属于(填“极性”、“非极性”)分子。
(3)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g C气体(已知n(X):n(Y)=3:1)可放出18.44 kJ热量,则该反应的热化学方程式为。
(4)由X、Y、Z、W四种元素组成的一种离子化合物D
①已知1mol D能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下D与NaOH溶液反应的离子方程式。
②又知D既能与盐酸反应,又能与氯水反应,写出D与氯水反应的离子方程式
。
(5)X的单质与Z的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,则M极的电极反应式为。
[化学——选修有机化学基础]
已知:
ⅰ. 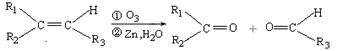 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.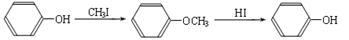
某种芳香族化合物A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。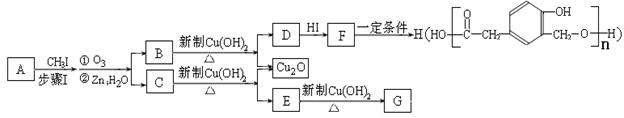
请回答:
(1)① F→H的反应类型是;气体G的相对分子质量是44,则E的结构简式是;
②步骤Ⅰ的目的是;
③A的结构简式是;上述转化中B→D的化学方程式是。
(2)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN只能与含1molBr2的浓溴水发生取代反应;
④ N分子中苯环上仅有三个取代基且取代基上无支链。请问符合上述要求N的同分异构体有种。
[化学—选修物质结构与性质]
第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。
(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子核外电子排布式______________________________。
(2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,右图正方体是Pt晶胞示意图,
叙述Pt原子在晶胞中位置:_______________________。
(3)已知X eO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为;XeO3分子实际空间构型为。
eO3分子中氙原子上有1对孤对电子,则XeO3为____________分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为;XeO3分子实际空间构型为。
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是。