半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl,遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通入干燥CO2的作用是 。通过控制K1、K2能除去A、B装置中的空气,具体的方法是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
某市进行学业水平考试实验操作考查,试题分别为:
Ⅰ.试验维生素C的化学性质(主要是还原性)。
Ⅱ.葡萄糖与新制氢氧化铜的反应。
Ⅲ.配制一定物质的量浓度的氯化钠溶液。
⑴试题中设置了“评价与反思”,下列“评价与反思”不合理的是:。(填序号)
| A.应该由监考老师去评价与反思 |
| B.实验结论告诉我:维生素C丸子应该密封保存 |
| C.维生素C能使淀粉的碘溶液褪色 |
| D.配制新制氢氧化铜时要将氢氧化钠与硫酸铜溶液等物质的量混合 |
E.实验Ⅲ中玻璃棒的作用是搅拌和引流
F.实验Ⅱ中的废水应该回收后再集中处理,不能直接倒入下水道
⑵实验Ⅲ中合理的实验操作顺序是:④。(填序号)
①溶解,②计算和称量,③转移和洗涤,④查漏,⑤定容和摇匀。
⑶实验Ⅱ考查结束后,发现试管内壁附着一层红色固体。为了洗干净试管,某学习小组尝试往试管中加适量(3mL)稀硝酸,发现红色固体立即消失,溶液呈蓝色,则该反应的离子方程式为: 。
(12分)实验室用加热l-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,还会有烯、醚等副产物生成。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷,已知相关有机物的性质如下:
| 熔点/oC |
沸点/oC |
|
| 1-丁醇 |
—89.53 |
—117.25 |
| 1-溴丁烷 |
—112.4 |
—101.6 |
| 丁醚 |
—95.3 |
—142.4 |
| 1-丁烯 |
—185.3 |
—6.5 |
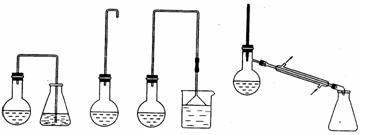
A B C D
⑴制备1-溴丁烷的装置应选用上图中的_______(填序号)。反应加热时的温度不宜超过
100℃,理由是_________________________。
⑵制备操作中,加入的浓硫酸必需进行稀释,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂。
⑶反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是______。该操作应控制的温度(t)范围是_______________。
⑷欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(15分)利用有机反应R-H+Cl2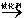 R-Cl(液)+HCl(气)制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
R-Cl(液)+HCl(气)制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题: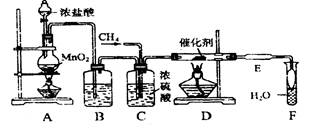
(1)装置B中盛放的溶液是
其作用是。
(2)写出C装置的三种功能:
①;
②;
③;
(3)玻璃管D中所放石棉碎块的作用是
玻璃管E中所放碘化钾的作用是
(4)F中导管末端做成“膨大”形的作用是
(5)①点燃A处酒精灯,②点燃D处酒精灯,③通入CH4,这三种操作的先后顺序是
__________ ___(依次填代号)
已知A的产量通常用来衡量一个国家的石油化工水平,D的结构可用右下图模型表示。现以A为主要原料合成F和高分子化合物E,其合成路线如下图所示。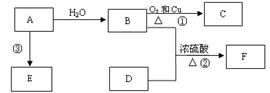

|
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。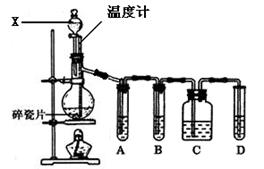
(1)装置中X仪器的名称是:;碎瓷片的作用是:。
(2)写出生成乙烯的反应方程式:。
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A.;B.;C.;D.。
(4)能说明SO2气体存在的现象是。
(5)确证含有乙烯的现象是。