某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯.
已知:
| |
密度(g/cm3) |
熔点(℃) |
沸点(℃) |
熔点(℃) |
| 环乙醇 |
0.96 |
25 |
161 |
难溶于水 |
| 环乙烯 |
0.81 |
﹣103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后用 (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从 口进入(填“g”或“f”).收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 .
实验室制取少量溴乙烷的装置如图所示。完成下列填空: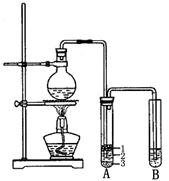
(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。
(2)写出加热时烧瓶中发生的主要反应的化学方程式。
(3)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第 层。
(4)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号)。
a. 蒸馏 b. 氢氧化钠溶液洗涤
c. 用四氯化碳萃取 d. 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的有机物的名称是。
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。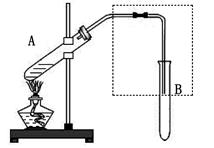
请根据该装置回答下列问题:
(1)若用乙醇与乙酸反应制取乙酸乙酯,反应的化学方程式为 ,试管B中应加入。虚线框中的导管除用于导气外,还兼有 作用。
(2)若用该装置分离乙酸和1-丙醇,则在试管A中除加入1-丙醇与乙酸外,还应先加入适量的试剂 ,加热到一定温度,试管B中收集到的是(填写结构简式)。冷却后,再向试管A中加入试剂 ,加热到一定温度,试管B中收集到的是 (填写结构简式)。
目前,我国石油资源紧张,大多数城市使用“乙醇汽油”。
(1)乙醇燃烧时,如果氧气不足会有CO生成。用下图所示装置连接后验证乙醇燃烧产物中有CO、CO2和H2O。则按气流从左到右,连接装置的编号顺序为。
(2)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是;B瓶溶液的作用是。
(3)装置①中所盛的是溶液,证明燃烧产物中含有CO的实验现象是。
(4)装置④中所盛的固体药品是,它验证的产物是。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol·L-1 FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 |
试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生 |
请回答下列问题:
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是___________________________________________________;实验中滴加FeCl3溶液的目的是________________________________________。
(3)实验②未观察到预期的实验现象。为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________(用实验中所提供的试剂或条件)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,分析判断OE、EF、FG三段中,___________段化学反应速率最快。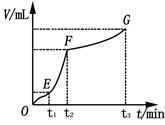
( 11分)乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH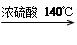 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)
(1)甲图和乙图是两套实验室制乙醚的装置,选装置___(填“甲”或“乙”)最合理,理由是_。
(2)反应液中应加入沸石,其作用是____________。
(3)反应中温度计的正确位置是水银球置于________________________。
(4)用上述装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是________________________________。
(5)如果温度太高(如170℃),将会发生一个有机副反应,反应方程式为:__________。