CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验 编号 |
温度 |
时间/min |
0 |
10 |
20 |
40 |
50 |
| 1 |
130 ℃ |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| 2 |
180 ℃ |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
|
0.15 |
(1)开展实验1和实验2的目的是______________________________。
(2)180 ℃时,反应到40 min,体系________(填“是”或“否”)达到平衡状态,理由是__________________________;
CH4的平衡转化率为________。
(3)已知130 ℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率α(NO2)的关系如图所示,请在图像中画出180 ℃时,压强为p2(设压强p2>p1)的变化曲线,并做必要的标注。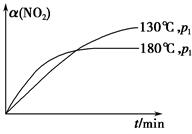
(5)根据已知求算:ΔH2=________。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
铁、铝、铜都是中学化学常见的金属.
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为: 。
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为: 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 。
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下: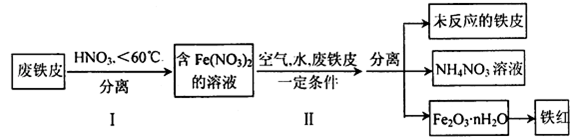
①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,
4Fe+10HNO3="4" Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是 ,第二个反应每生成1molNH4NO3,被还原的硝酸的物质的量是 。
③如何检验NH4NO3溶液中的NH4+离子,请描述操作 ,写出相关的离子反应方程式 。
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入 。
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母) 。
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)反应③的化学方程式是 。
(6)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4) 作电极组成电池,其工作原理为:
Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是 。
工业上制取氢气除电解水外还有多种方法.
(1)工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R在周期表的位置为 .
②常温下,不能与M单质发生反应的是 (填序号).
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)工业上也可利用化石燃料开采、加工过程中产生的H2S废气制取氢气.
①高温热分解法已知:H2S(g)⇌H2(g)+S(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果见图1.图中a为H2S的平衡转化率与温度关系曲线,b为表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率的变化曲线.据图计算985℃时H2S按上述反应分解的平衡常数K= ;随着温度的升高,曲线b向曲线a逼近的原因是
②电化学法:该法制取氢气的过程如图2所示.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .
反应后的溶液进入电解池,电解总反应的离子方程为 .
(3)H2S在足量氧气中燃烧可以得SO2,若在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol.若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,SO3的物质的量的取值范围为 mol.
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如右图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。