(14分)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下
(1)写出催化反应室1中在一定条件下进行的化学方程式: 。
(2)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,
则:①P1 P2。(填“<”、“>”或“=”)
②在其它条件不变的情况下,反应室3再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 。(填“增大”、“减小”或“不变”)
③在P1压强下,100℃时,反应:CH3OH(g) CO(g)+2H2(g)的平衡常数为 。(用含a、V的代数式表示)。
CO(g)+2H2(g)的平衡常数为 。(用含a、V的代数式表示)。
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。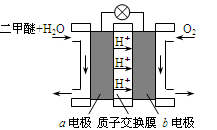
(4)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
则反应:3H2(g) +3CO(g) CH3OCH3(g)+CO2(g)的ΔH= 。
CH3OCH3(g)+CO2(g)的ΔH= 。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是。
(2)已知:①2Cu(s)+1/2O2(g)=Cu2O(s)△H = -akJ·mol-1
②C(s)+1/2O2(g)=CO(g)△H = -bkJ·mol-1
③Cu(s)+1/2O2(g)=CuO(s)△H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g)△H =kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为。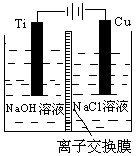
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为。已知肼与氨相似,则它与足量盐酸反应的方程式
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)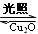 2H2(g)+ O2(g)△H>0 水蒸气的浓度随时间t变化如下表所示。
2H2(g)+ O2(g)△H>0 水蒸气的浓度随时间t变化如下表所示。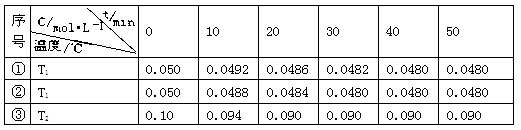
下列叙述正确的是(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为: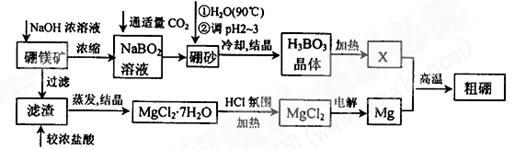
回答下列有关问题:
(1)硼砂中B的化合价为,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是。若用惰性电极电解MgCl2溶液,其阴极反应式为。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为。常温下,若起始电解质溶液pH=1,则当溶液pH=6时,(填“有”或“没有”)Mg(OH) 2沉淀析出。(已知Ksp[Mg(OH) 2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2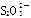 ===2I-+
===2I-+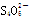 )(结果保留一位小数)。
)(结果保留一位小数)。
图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)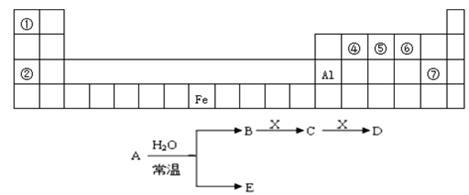
(1)若E为氧化物,则A与水反应的化学方程式为,该反应中氧化剂和还原剂的物质的量之比为.
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为.
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为.
(2)若E为单质气体,D为白色沉淀,B含有的化学键类型为,C与X反应的离子方程式为.
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为.
(12分)用所学的化学知识,回答下列问题:
(1)从海水中提取镁的主要步骤有:
①浓缩结晶(在HCl气流中)②加熟石灰③加盐酸④过滤⑤熔融电解,
请按照顺序写出正确的操作步骤(填序号):____________________
(2)化学方程式(未配平)As2S3 +H2O+NO3- = AsO43-+NO+ _______+SO42-,回答下面的问题:
A.反应后溶液显_____性(写酸、碱、中);B.每1mol水参加反应,该反应转移电子的数目为_______
(3)向过量的FeSO4溶液中加入几滴NaClO溶液,并且加入少量稀硫酸,发现溶液变成黄色。某同学认为该反应的还原产物有两种可能性,可能是Cl2或Cl-;而实验证明还原产物只存在Cl- 。回答下列问题:
A.还原产物中不存在氯气的原因是__________________________ (用化学用语表示)
B.写出上述过程的离子方程式____________________________________
C.为了检验上述反应是否生成了Cl-,请从下面选择合适的序号,并按照先后顺序排列,进行实验操作。则正确的操作顺序为__________________
A.取一支试管,加入上述反应后的溶液的少许;
B.加入过量的氯化钡溶液;
C.加入过量的硝酸钡溶液;
D.加入硝酸酸化的硝酸银溶液,观察到白色沉淀;
E.过滤,取滤液
(8分)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用酸性KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40mol/L的酸性 KMnO4溶液滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
①滴定终点时的现象是________________________________________________________
②写出该滴定反应的离子方程式__________________________________________________
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测定结果________(填“偏高”“偏低”或“不变”)
④经计算,产品中Na2S2O3·5H2O的质量分数为________