某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到加入一滴盐酸后,溶液颜色由黄色变为橙色,并 为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的是 。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束后俯视读数 |
(3)某学生根据3次实验分别记录有关数据如表:
依据上表数据列式计算该氢氧化钠溶液的物质的量浓度为 。
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,方方同学认为产生的气体除SO2外,还可能产生氢气。该同学为了验证他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答: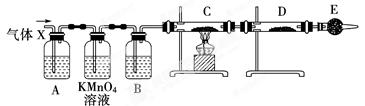
(1) E中加入的试剂是碱石灰,作用是_____________;装置A、B之间的酸性高锰酸钾溶液的作用是_________________;
(2)上述反应中生成二氧化硫的化学方程式为___________________________________;
(3)如果去掉装置B,就不能根据D中的现象判断气体X中有氢气,原因是:_______________________。
(4可以证明气体X中含有氢气的实验现象是:
C中______________________________,D中_______________________。
(14分)某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)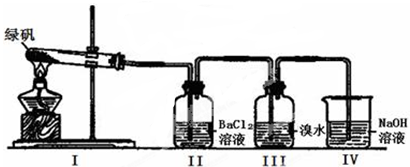
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。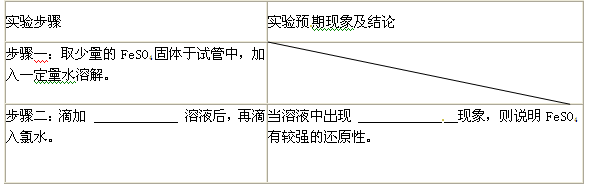
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________。
研究性学习小组进行CH4的性质探究实验。
(1)通入高锰酸钾酸性溶液,现象是____。
(2)在无色玻璃集气瓶中与Cl2混合后光照,现象是____。
(3)为了验证CH4是否具有还原性,某小组设计了如下实验: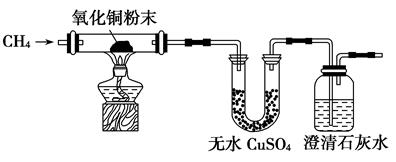
实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是______。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图) ______。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:
①取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水硫酸铜和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
②将少许研碎的维生素C样品和适量的紫色石蕊试液充分混合后,溶液颜色变红。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是mo1;碳元素的质量是g。
(2)维生素C中(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是。
(4)维生素C和紫色石蕊试液混合后,溶液颜色变红,说明维生素C溶液具有(填“酸”、“碱”或“中”)性。查阅有关资料显示,维生素C具有还原性。请以淀粉溶液、碘水为试剂,写出验证维生素C具有还原性的实验方法和现象:。
含苯酚的工业废水的方案如下图所示: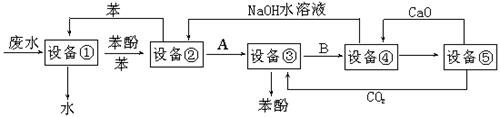
回答下列问题:
(1)设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是。
(2)由设备②进入设备③的物质A是。
(3)在设备③中发生反应的化学方程式为。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键