“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1 100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向 进行(填“左”或“右”),判断依据是 。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②反应达到平衡后,下列措施能使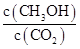 增大的是 (填符号)。
增大的是 (填符号)。
| A.升高温度 | B.再充入H2 | C.再充入CO2 | D.将H2O(g)从体系中分离 |
E.充入He(g)
FeO易被氧化,配平:
_______FeO+_______HNO3(稀)=_______Fe(NO3)3+________NO↑+________H2O,
该反应中,氧化剂和还原剂的物质的量之比为____________;若反应中转移了0.15mol电子,则产生的气体在标准状况下的体积为__________L。
请填写相应物质的编号:
①Fe2O3 ②Fe3O4 ③KAl(SO4)2·12H2O ④Si ⑤SiO2
水晶、玛瑙的主要成份是________________;常用作红色油漆和涂料的物质是_________;易与水生成胶体,常用作净水剂的是________。
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下: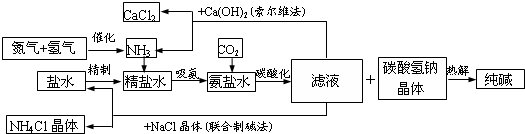
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是_______,该操作中所用的仪器有铁架台(带铁圈)、烧杯等,还需要使用的仪器有___________,溶液中多余的纯碱可以加_________试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是_________。整个过程中循环利用的物质是________(用化学式表示)。
(3)(4)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于_____L(不考虑二氧化碳的回收利用)。
(1)抗酸性药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。①抗胃酸药物具有抗酸作用的原因是___________,某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉.写出该抗酸药发挥功效时的离子方程式:_____、_____;
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)___________;
(2)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础,材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子材料及复合材料,生活中的玻璃、陶瓷、水泥属于上述材料中的_______,其生产原料不需要使用石灰石的是_______,我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
| 纤维编号 |
① |
② |
③ |
| 灼烧时的气味 |
特殊气味 |
烧纸气味 |
烧焦羽毛气味 |
则羊毛、棉花的编号分别为________________。
(3)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为品牌燕麦片标签中的一部分。
| 每100g含有 营养成分 |
糖类 |
油脂 |
蛋白质 |
维生素C |
钙 |
镁 |
钠 |
锌 |
| 7.6g |
7.8g |
7.4g |
18mg |
201mg |
18.2mg |
30.8mg |
8.1mg |
燕麦片的营养成分中能与水反应生成氨基酸的营养物质是________;每克营养物质氧化时放出能量最多的是________;人体必需的微量元素是________ ,“服用维生素C,可使食物中的Fe3+变为Fe2+”这句话指出,维生素C在这一反应中作_______剂。
A.《化学与生活》
Ⅰ.随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质不足引起的。蛋白质在人体内水解的最终产物是__________
(2)被称为东方神药的青蒿素每年都在挽救全世界无数人的生命,中国女科学家屠呦呦获得2015年诺贝尔生理学或医学奖,以表彰其对治疗疟疾药物青蒿素的研究贡献。
下列有关青蒿素(化学式为C15H22O5)说法不正确的是__________
A.青蒿素易溶于酒精、水等溶剂
B.青蒿素由碳、氢、氧三种元素组成
C.每个青蒿素分子由15个碳原子、22个氢原子、5个氧原子构成
D.青蒿素不可以发生水解反应
E.青蒿素中氢元素的质量分数是22/280
(3)可以帮助流感病人解热镇痛的药物是____________(选填“青霉素”或“阿司匹林”)。胃舒平(氢氧化铝)可用于治疗胃酸过多,请写出有关离子方程式_________________。
Ⅱ材料的不断发展可以促进社会进步。
(1)钢铁是制造航母的主要材料,钢铁在潮湿空气中易发生________腐蚀,其负极反应是__________。请列举一种防止钢铁腐蚀的方法:_________________。
(2)不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于 (填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
(3)氮化硅是一种新型高温材料,可用于制造汽车发动机。请写出高纯硅和氮气在1300℃时反应制备氮化硅的化学方程式:___________________________________。
Ⅲ我国新修订的《环境保护法》,使环境保护有了更严格的法律依据。
(1)往燃煤中加入 (填化学式),可大大减少产物中的SO2。
(2)漂白粉用于生活用水的杀菌消毒,漂白粉的有效成份是 (填化学式)。治理废水中的重金属污染物可用沉淀法。例如,往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为 (填化学式)沉淀而除去。