科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。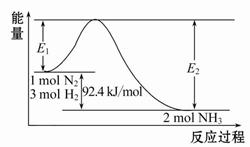
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
ΔH="+1" 530 kJ/mol
又知:H2O(l) H2O(g) ΔH="+44.0" kJ/mol
H2O(g) ΔH="+44.0" kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
. 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时n(H2)/n(CH3OH)增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
| A.相等 | B.前者小于后者 | C.前者大于后者 | D.无法确定 |
②a.b.c必需满足的关系是(一个用a.c表示,另一个用b.c表示):___。
(13分)在100℃时,将0.100 mol 的四氧化二氮气体充入 1 L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)(mol/L) |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)(mol/L) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为______________________;
从表中分析:c1________c2;c3________c4(填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线。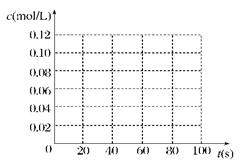
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。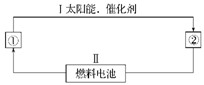
(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。
(4分)1836年,俄国籍瑞士化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应的热化学方程式,回答问题。
已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)===NH3(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH=-72.3 kJ/mol
④NH3(aq)+HCl(aq)===NH4Cl(aq) ΔH=-52.3 kJ/mol
⑤NH4Cl(s)===NH4Cl(aq) ΔH=?
则第⑤个热化学方程式中的反应热是 。