CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。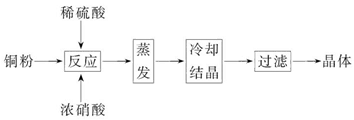
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:_____________、_____________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_____________,除去这种杂质的实验操作称为_____________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。称取0.100 0 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.100 0 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用
0.100 0 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.100 0 g该试样中含CuSO4·5H2O_____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用_____________。
研究 、
、 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。
(1) 可使
可使 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
写出CO(g)与 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,K+移向_______极(填“正”或“负”),正极反应方程式为:___________________。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①该复合肥料可能的化学式为___________(写出一种即可)。
②若氨水与 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水

③向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)
此时溶液中 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(4) 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为;1 mol C60分子中π键的数目为。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有(按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键。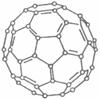
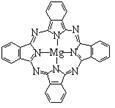
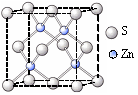
图1图2图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:AsSe(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图所示),硫离子的配位数是。
③二氧化硒分子的空间构型为。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为。
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为280(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请回答下列问题。
(1)该泉水属于硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂加入时的先后次序是,原因是。
(3)目前常用阴、阳离子交换树脂来进行硬水的软化,如水中的Ca2+、Mg2+可与交换树脂中的交换。当阴离子交换树脂失效后可放入溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。右边是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: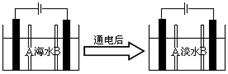
①阳离子交换膜是指(填A或B);
②写出通电后阳极区的电极反应式:。
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是。发生反应的离子方程式为;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 |
操作 |
现象及结论 |
| 1 |
用甲、乙两支试管分别取两种溶液各少许。 |
|
| 2 |
用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 |
|
| 3 |
。 |
,则甲是,乙是。 ,则甲是,乙是。 |
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂。
(1)填写下表
| 物质(杂质) |
除去杂质 所需试剂或方法 |
离子方程式 (若无离子方程式,则写化学方程式) |
| Fe(Al) |
||
| SiO2(CaCO3) |
||
| CO2(HCl) |
||
| NaHCO3溶液(Na2CO3) |
||
| Na2CO3(NaHCO3) |
||
| Al2O3(Al(OH)3) |
(2)将二氧化硫通入到氯化钡溶液中未见到明显现象,继续通入向该溶液中滴加氯水或氨水,均见到白色沉淀产生,该沉淀的成分分别为或,请分别写出发生反应的离子方程式,。