合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。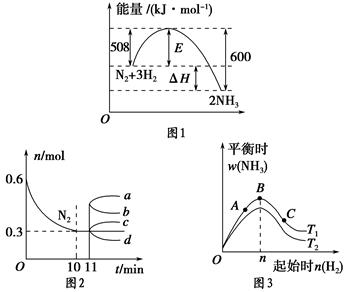
下列说法正确的是 ( )。
A.由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,
从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中A、B、C三点所处的平衡状态中,反应物N2的转化率最高的是B点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是 ( )
| A.NaOH | B.H2SO4 |
| C.AgNO3 | D.Na2SO4 |
X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡,W、Y相连时,W极发生氧化反应。据此判断四种金属的活动顺序是( )
| A.X>Z>W>Y | B.Z>X>Y>W |
| C.X>Y>Z>W | D.Y>W>Z>X |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe2++4OH-。以下说法正确的是( )
| A.负极发生的反应为:Fe-2e-===Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-===4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
对于锌—铜—稀H2SO4组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g
③铜片上析出1 g H2 ④铜片上析出1 mol H2
| A.①和③ | B.①和④ | C.②和③ | D.②和④ |
将等物质的量K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,经搅拌、静置、过滤。取滤液,用铂电极电解该滤液一段时间。则两个极区析出的氧化产物与还原产物的质量比约为( )
| A.35.5∶108 | B.108∶35.5 |
| C.8∶1 | D.1∶2 |