下表中评价合理的是( )
| 选项 |
化学反应及其离子方程式 |
评价 |
| A |
Fe3O4与稀硝酸反应:2Fe3O4+18H+ =6Fe3++H2↑+8H2O |
正确 |
| B |
向碳酸镁中加入稀盐酸: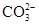 +2H+ =CO2↑+H2O +2H+ =CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
| C |
向硫酸铵溶液中加入氢氧化钡溶液: Ba2++ 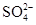 =" " BaSO4↓ =" " BaSO4↓ |
正确 |
| D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1∶2 |
已知酸H2B在水溶液中存在下列关系:①H2B = H++HB—,②HB— H++B2—,则下列说法中一定正确的是
H++B2—,则下列说法中一定正确的是
| A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
| B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性 |
C.NaHB水溶液中一定有:c(Na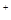 )+c(H )+c(H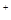 )=c(HB )=c(HB )+c(OH )+c(OH )+c(B )+c(B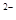 ) ) |
D.在Na2B溶液中一定有:c(OH )=c(H )=c(H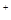 )+c(HB )+c(HB ) ) |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的PH值范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是 A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 B.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4
B.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液 D.向该溶液中加少量铁粉即能观察到红色固体析出
D.向该溶液中加少量铁粉即能观察到红色固体析出
下列溶液中微粒的物质的量浓度关系错误的是 A.0. 1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
A.0. 1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
B .1 L0.1mol·L-1 (NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
.1 L0.1mol·L-1 (NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.浓度均为0. 1mol·L-1的NaHCO3和Na2CO3混合液:
c(Na+) >c(CO32-)>c(HCO3-) >c(OH-)>c(H+) D.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
D.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)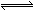 CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H<0 |
| C.800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D.800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
下列离子方程式书写不正确的是
| A.碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O |
| B.含等物质的量的硫酸氢钠与氢氧化钡两溶液混合: H+ + SO42-+Ba2+ +OH- = BaSO4 ↓+H2O |
| C.用稀硝酸浸泡做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
D.用两个铜电极电解饱和食盐水:2Cl—+2H2O 2OH—+H2↑+Cl2↑ 2OH—+H2↑+Cl2↑ |