烧结法制氧化铝生产过程如下: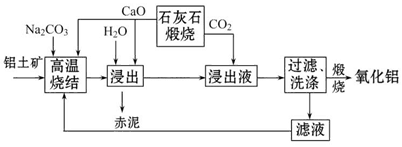
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
(16分)
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y.已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,则:
①A的分子构型为。
②反应Ⅰ的化学方程式为。
③化合物NaX3是合成“达菲”的中间活性物质,NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式。
(2)若A、B、C、D均为含Y元素的化合物,且A的摩尔质量为120 g·mol ,则:
,则:
①反应Ⅳ的溶液加热蒸干所得的晶体属于晶体(填“离子”、“分子”、“原子”).
②反应I的化学方程式为。
③若灼烧6gA产生的B(气态)全部转化为C(气态)时放出9.83 KJ热量,请写第Ⅱ步反应的热化学方程式。
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a. (式中O→O表示共用电子对由前一个氧原子提供)和b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和b.H—O—O—H
①请用电子式表示b的结构。
②写出H2O2在水溶液中的电离方程式。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2 + KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为:

 试写出阳极的电极反应式。
试写出阳极的电极反应式。
已知溴乙烷跟氰化钠反应后再水解可以得到丙酸:
|
|

 CH3CH2Br CH3CH2CN CH3CH2COOH
CH3CH2Br CH3CH2CN CH3CH2COOH
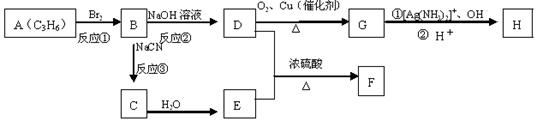
苹果酸是一种常见的有机酸,其结构为:
(1)苹果酸含有的官能团名称是;在一定条件下,苹果酸可发生化学反应的类型有(填序号);
| A.水解反应 | B.取代反应 | C.加成反应 |
| D.消去反应 E.加聚反应 F.中和反应 |
(2)下列物质与苹果酸互为同分异构体的是(填序号);
 |
(3)写出苹果酸与金属钠发生反应的化学方程式:;
(4)写出苹果酸与氧气在铜作催化剂加热的条件下发生反应所得的可能产物的结构
式。
酯是重要的有机合成中间体,请回答下列问题:
(1)实验室制取乙酸乙酯的实验中,烧瓶中除加入乙醇、浓硫酸和无水乙酸外,还应放入碎瓷片,其目的是。烧瓶中发生的反应的化学方程式为。
(2)欲提高乙酸的转化率,可采取的措施有、等。 (3)锥形瓶内收集的乙酸乙酯粗产品中所含杂质
(3)锥形瓶内收集的乙酸乙酯粗产品中所含杂质
主要有。
(4)实验时可观察到锥形瓶中有气泡产生,
用离子方程式表示产生气泡的原因:。
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题。现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.7 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
(说明:选择性100%表示反应生成的产物是乙酸乙酯和水)
根据表中数据,下列_________(填编号),为该反应的最佳条件。
| A.120℃,4h | B.80℃,2h | C.60℃,4h | D.40℃,3h |