多晶硅是太阳能光伏产业的重要原材料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s)=SiO(g)+CO(g) ΔH=a kJ·mol-1
2SiO(g)=Si(s)+SiO2(s) ΔH=b kJ·mol-1
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式为________________________________。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:
SiHCl3(g)+H2(g)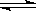 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。
不同温度及不同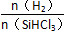 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。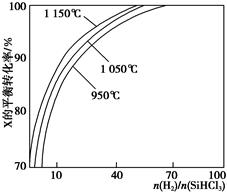
①X是________(填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1 150 ℃)________K(950 ℃)(填“>”、“<”或“=”)。
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔融盐电解法制取硅烷原理如图所示,电解时阳极的电极反应式为_________________________________________。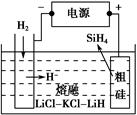
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为________。
(8分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| l |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |
(1)体系中发生反应的化学方程式是;
(2)列式并计算该反应在O-5min时间内产物Z的平均反应速率:;
(3)该反应在第分钟(min)时达到平衡状态;
(4)若使该反应的速率增加,下列措施一定不能达到目的的是。
A.升高温度
B.降低温度
C.使用催化剂
D.保持容器体积不变加入lmolx和2moly
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程_________________________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:_______________________________________________________。
在一定条件下,可逆反应:mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)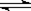 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
(1)写出左试管中主要反应的方程式:;
(2)加入浓硫酸的作用:__________ ________;
(3)饱和Na2CO3的作用是:_____________________________________________;
(4)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称),所需主要仪器为。
(5)实验生成的乙酸乙酯,其密度比水,有气味。