[物质结构与性质]已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题:
(1)写出F元素的电子排布式:________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为__________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子立体构型是________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图: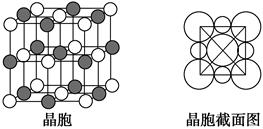
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(用含NA与ρ的式子表达)。
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题: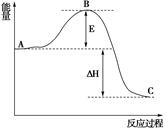
①图中E、C分别表示、,
②E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是
③图中△H=kJ·mol-1。
B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂。并能进行如图所示的反应。且D能发生加聚反应。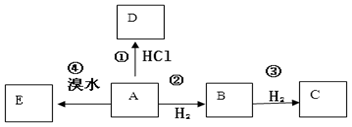
(1)写出A的结构简式
(2)下列反应的化学方程式和反应类型
反应②:;
(3)写出A与足量的溴水反应的方程式且命名产物:;
(4)写出D在一定条件下发生加聚反应的化学反应方程式:
某溶液中可能含有Cl-、SO42-、NO3-、CO32-等阴离子。
(1)、当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是。原因是(用离子方程式表示)。
(2)、当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是。
按要求完成下列化学用语:
(1)NaHSO4的电离方程式:,
(2)CuSO4溶液和NaOH溶液反应的离子方程式:,
(3)能用H++OH-=H2O表示的一个化学方程式:。
(1)1mol H2O和1mol H2O2相比较,分子数之比为:
氧原子数之比为:;质量之比为:(最简单整数比)
(2)2mol H2SO4的质量为g,所含氧原子数目为。