为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )。
| |
电池 |
电解池 |
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3 mol Pb |
生成2 mol Al2O3 |
| C |
正极:PbO2+4H++2e-=Pb2++2H2O |
阳极:3Al+3H2O-6e-=Al2O3+6H+ |
| D |
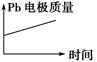 |
 |
下列表示对应化学反应的离子方程式正确的是
| A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ | B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.Cl2+H2O=HCl+HClO | D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.1.5 mol/L | C.0.18 mol/L | D.0.24mol/L |
设nA为阿伏伽德罗常数的数值,下列说法正确的是
| A.1molFe2+ 与足量的H2O2溶液反应,转移2nA个电子 |
| B.1L0.1mol•L-1的氨水含有0.1nA个OH― |
| C.常温常压下,22.4LCCl4含有个nA个CCl4分子 |
| D.常温下,23g NO2含有nA个氧原子 |