有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________(写分子式),它们的稳定性由弱到强的顺序是________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示:
其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
(6分)选择合适的试剂(适量)对下列待提纯的物质进行除杂(括号内为杂质),并写出相应的离子方程式。
| 待提纯的物质 |
选用的试剂 |
相应离子方程式 |
| (1)CO(CO2) |
||
| (2) FeCl3 (FeCl2) |
||
| (3) Na2CO3溶液(NaHCO3) |
(填序号)下列物质属于电解质的是;属于非电解质的是;能导电的物质是。
①蔗糖 ②烧碱 ③CO2 ④碳酸钙 ⑤铜 ⑥石墨
(1)9.03×1023个CO2的物质的量是,质量是g,在标准状况下的体积为L,其中含有个氧原子。
(2)在100mL2mol/LH2SO4溶液中,H2SO4的质量是,H+的物质的量浓度为。
(3)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为。
钠、氯及其化合物有如下转化关系,请按要求填空: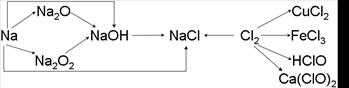
(1)金属钠的密度比水,实验室中金属钠通常保存在中。金属钠投入水中,剧烈反应,反应的化学方程式为。
(2)Na2O2 是色的固体,Na2O2 可用于呼吸面具作氧气的来源,有关反应的化学方程式为。
(3)通常情况下,为了防止Cl2污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为。若NaOH溶液吸收了33.6L(标况) Cl2反应转移的电子的数目为。
(4)将新制氯水滴入AgNO3溶液中,观察到现象,原因是。将红色布条投到新制氯水中,观察到红色布条退色,原因是。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
HX +  (X为卤素原子)
(X为卤素原子)
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是________ _______________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分
子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
_____________________________,_______________________________。