硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·
L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是___________________________________。
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是______________________________________________________________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________________________________________________________。
某同学想通过下图装置实验、探究SO2与Na2O2反应的产物。
(夹持装置已略去,装置的气密性良好)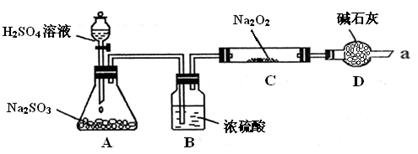
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)
。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是
。
Ⅱ.某同学想通过上图实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先
②再用带火星的木条靠近干燥管口a,观察其是否复燃。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:。
(1)若假设2成立,写出所发生反应的化学方程式
。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4。
该方案是否合理(填“是”或“否”)。
(3)设计实验验证假设3的实验步骤如下:
| 实验步骤 |
实验现象 |
| ①滴加入过量的稀盐酸 |
产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 |
产生白色沉淀。 |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
若假设3成立,正确的实验操作顺序是
某同学欲配制100mL0.20mol,L-1的KCl溶液,实验操作如下:
(A)用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
(B)加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
(C)将KCl溶液由烧杯小心倒入100mL容量瓶中;
(D)然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
(E)使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____ _____(填写编号)。
(2)下面哪些操作会导致所配的100mLO.20mol/L的KCl溶液浓度降低_ ___。
(A)容量瓶用蒸馏水洗涤三次直到洗净, (B)称量KCl固体时将砝码放在左盘
(C)未洗涤转移KCl溶液的烧杯, (D)转移KCl溶液时有KCl溶液溅出
(E)定容时仰视刻度线
(3)若用O.2mol,L-1的KCl溶液配制0.05mol,L-1的KCl溶液200.0mL,需要O.20mol,L-1的KCl溶液mL,
(4)已知在标准状况下1L水可以溶解VLHCl气体,此时所形成的溶液密度为ρg/mL,(相对原子质量Cl35.5 H 1),该溶液物质的量浓度为: (mol/L)
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A.试样中含有加热不挥发的杂质 | B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 | D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全 F.加热时有晶体溅出
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。