(1)按系统命名法为下列有机物命名

① ,② ;
(2)根据名称写出有机物结构简式
2,5-二甲基-4-乙基庚烷 ;
(3)戊烷(C5H12)的某种同分异构体只有一种一氯代物,试书写戊烷此同分异构体的结构简式: ;
(4)有两种有机物都含有碳92.3%,含有氢7.7%,第一种有机物对氢气的相对密度为13,第二种有机物的蒸气密度为3.49 g/L(已折算成标准状况下的值), 则第一种有机物的结构简式为 ,第二种有机物的分子式为 。
据报道,卫生部决定从2011年5月1日起禁用面粉增白剂。资料显示,目前应用于面粉的增白剂几乎全是过氧化苯甲酰,它能对面粉起到漂白和防腐的作用,且已经过安全评估,但是有研究认为它对人体有一定的负面作用。过氧化苯甲酰的合成路线如下: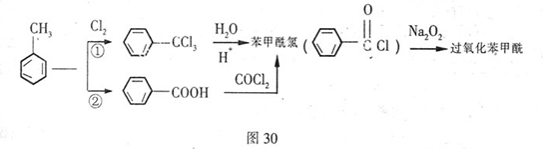
(1)过氧化苯甲酰的组成元素仅为C、H、O,其中含氧质量分数为26.45%,相对分子质量为242,通过计算和推理可知,过氧化苯甲酰的分子式为,结构简式为。
(2)反应①、②的反应类型分别为和,反应①所需的条件为。
(3)苯甲酸有多种同分异构体,其中属于芳香族化合物有种(不含苯甲酸)。
(4)苯甲酰氯也有多种同分异构体,其中邻氯苯甲醛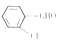 可用于制备一种重要的有机化工原料水杨酸
可用于制备一种重要的有机化工原料水杨酸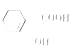 ,使用流程图表示其制备过程。
,使用流程图表示其制备过程。
(流程图示例如下:CH3CH2OH H2C=CH2
H2C=CH2 BrH2CCH2Br)
BrH2CCH2Br)
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。
(1)写出实验室制备乙酸乙酯的化学方程式。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下: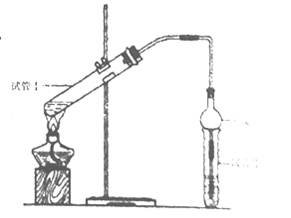
的厚度,实验记录如下
| 实验编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中的试剂 |
测得有机层的厚度/cm |
| A |
2mL乙醇、2 mL乙酸、1 mL 18mol/L浓硫酸 |
饱和碳酸钠溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
0.1 |
|
| C |
3 mL乙醇、2 mL乙酸、6 mL 3mol/L硫酸 |
1.2 |
|
| D |
3 mL乙醇、2 mL乙酸、盐酸 |
1.2 |
(1)干燥管的作用是:,试管Ⅱ中盛放的碳酸钠溶液(填“能”或“不能”)改为氢氧化钠溶液,原因是。
(2)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是mL和mol/L。
(3)分析实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是。
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,一个可能的原因是。
以黄铜矿(CuFeS2)为原料冶炼铜的反应为:
8CuFeS2+21O2

(1)若Cu为+2价,则反应中每生成1molCu需要转移mol电子。
(2)为综合利用炉气中的大量SO2,下列方案合理的是。
a.用浓硫酸吸收 b.用于制备硫酸
c.高空排放 d.用纯碱液吸收制亚硫酸钠
(3)为检验所得矿渣是中是否含有FeO、Fe2O3、CuO、A12O3、SiO2等氧化物,进行了以下实验;
①取一定量矿渣粉末,加入适量浓硫酸后加热,固体全部溶解,得溶液A;将产生的气体通入品红溶液中,溶液褪色。由此判断矿渣中一定含有,一定没有。
②将溶液A稀释后分成两份,取其中一份,加入过量NaOH溶液,有沉淀产生,静置后取上层清液,通入过量的CO2溶液变浑浊。由此判断出矿渣中含有,写出通入过量的CO2所发生反应的离子方程式:。
③取另一份溶液A加入过量的铁粉充分反应后过滤,得到的固体中有红色物质,由此判断矿渣中有,写出此步操作中得到红色物质所发生反应的离子方程式。
X、Y、Z、W、M是五种原子序数依次增大的短周期元素,其中X、Y、M在周期表中的位置如右图所示,又知W的最外层电子数是内层电子数的3倍,试回答下列问题: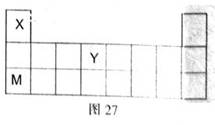
(1)Y在周期中的位置是:,M的最高价氧化物的水化物电子式为:。
(2)由这五种元素中的两种元素形成的既含极性共价键又含非极性共价键的化合物有很多种,请写出其中两种四原子分子的结构式:、。
(3)由这五种元素形成的单质或化合物中,能与水发生化学反应的有多种,请任写出其中一种与水反应后生成一种单质和一种化合物的化学反应方程式。
(4)在微电子工业中,用Z的气态氢化物甲的水溶液作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境。写出该反应的化学方程式:。
(5)在合成甲的反应过程中,反应速率与时间的图像如图所示,则在t1-t6时间内的甲的体积分数最小的时刻是,t3时刻改变的外界条件是,合成甲的反应是反应(填“吸热”或“放热”)。
A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
请回答:
(1)A转化为B、C时,涉及到的有机反应类型是___________________。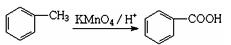
(2)B的结构简式是_。
(3)已知:酰氯能与含有羟基的物质反应生成酯类物质。例如:
写出草酰氯(分子结构式:)与足量有机物D反应的化学方程式:
。
(4)已知:
由邻甲基苯酚经过两步反应可生成有机物A。请写出中间产物的结构简式。
(5)上题(4)中的中间产物有多种同分异构体,请写出其中一种符合下列条件的结构简式:①苯环上有两个侧链;②苯环上的一氯代物只有两种;③能发生银镜反应;④含有羟基,但遇FeCl3溶液不发生显色反应。__________________