导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=_________;用O2的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A. B.容器内压强保持不变.
B.容器内压强保持不变.
C. D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染, 请写出CH4与NO反应的化学方程式:_________;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应)。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。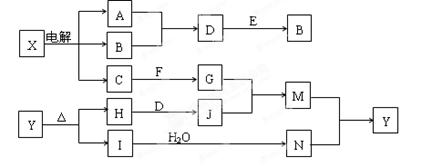
请回答下列问题:(1)B中所含元素位于周期表中第周期族。
(2)A在B中燃烧的现象是。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是。
(4)G + J → M的离子方程式是。
(5)Y受热分解的化学方程式是。
【化学——选修3:物质结构与性质】
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为;溴的价电子排布式为。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是。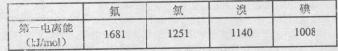
(4)下列分子既不存在s-p 键,也不存在p-p
键,也不存在p-p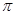 键的是。
键的是。
A. HCl B.HF C.SO2 D.SCl2
(5)已知ClO2一为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为
,写出CN-的等电子体的分子式(写出1个)。
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构如图所示:由此可判断该钙的氧化物的化学式为____。已知该氧化物的密度是 g·cm-3,则晶胞离得最近的两个钙离子间的距离为____cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为____cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。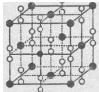
工业上研究燃料脱硫的过程中,涉及如下反应:
CaSO4(s)+CO(g)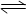 CaO(s)+SO2(g)+CO2(g),K1,△H1=" 218.4" kJ·mol-l(反应I)
CaO(s)+SO2(g)+CO2(g),K1,△H1=" 218.4" kJ·mol-l(反应I) CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)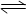
 CaS(s)+2CO2(g),K2,△H2=" -87.8" kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2=" -87.8" kJ·mol-l(反应II)
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H=;平衡常数K=____(用K1,K2表示)。
CaS(s)+3CO2(g)的△H=;平衡常数K=____(用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
前100 s 内v(SO2)=mo1·L-1·s-l,平衡时CO的转化率为。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____。
| A.体系中气体的平均摩尔质量不再改变 |
| B.v(CO)=v(CO2) |
| C.CO的转化率达到了最大限度 |
| D.体系内气体压强不再发生变化 |
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是
____。
②图像中T2T1(填“高于”、“低于”、“等于”或“无法确定”):判断的
理由是____。
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 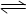 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 |
制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____,正极反应为:____。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____mol。
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
| 化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点,/℃ |
溶解度/l00g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
操作如下:
①在50mL三颈烧瓶中,加入18.5 mL正丁醇和13.4 mL冰醋酸, 3~4滴浓硫酸,投入沸石。安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗, 10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管(填a或b)端管口通入。
(2)仪器A中发生反应的化学方程式为____。
(3)步骤①“不断分离除去反应生成的水”该操作的目的是:。
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是。
(5)进行分液操作时,使用的漏斗是____(填选项)。
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏___(填“高”或者“低”)原因是____
(7)该实验过程中,生成乙酸正丁酯的产率是。