工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下: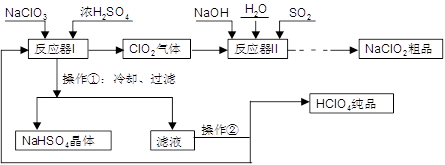
(1)实验室进行过滤操作的常用玻璃仪器有 。
(2)反应器I中的温度最佳为 (填序号);操作②的名称为 。
A. 0°C ; B. 20°C ; C. 80°C ; D. 120°C
(3)反应器II中发生反应的离子方程式为 。
(4)加快反应器II中反应速率的措施有 (写出一种措施即可)等。从反应器II中获得NaClO2 粗品的实验操作依次是 (填序号,下同),进一步提纯的操作名称为 。
A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶 G.萃取分液
(5)上述流程中可循环使用的物质为 ,副产品除NaClO2、NaHSO4外还有 (填化学式)。
已知某元素气态氢化物的化学式为H2R—RH2,其中氢元素的质量分数为12.5%,则:
(1)R元素的相对原子质量为Ar(R)=___________________。
(2)R元素在H2R—RH2中的化合价为_______________,R元素的最低负价为____________,最高正价为_________________。
下列转化关系中,A—L均为中学化学中常见的物质,其中D为用途广泛的金属单质,B在常温常压下为无色液体,G为不溶于水但可溶于酸的白色固体,I为无色气体且能使湿润的红色石蕊试纸变蓝,L为无色气体,遇空气变为红棕色。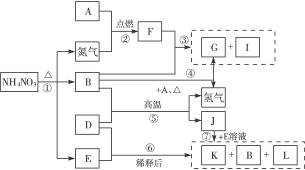
请完成下列问题:
(1)构成单质D的元素在元素周期表中处于第____________周期____________族。
(2)I物质的电子式为____________,F物质的化学式为____________;它们的晶体类型分别是:____________、____________。
(3)写出下列反应的化学方程式:
③___________________________________________;
⑤___________________________________________。
A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2,其水溶液呈弱酸性。请回答:
(1)元素符号:A____________;B____________;C____________;D____________。
(2)写出化学方程式:C2和X(过量)反应:_______________________。
(3)B4A3D2的化学式为:_____________________________,其水溶液呈酸性的离子方程式是:_________________________________________________。
有A、B、C、D四种单质,在一定条件下,A、B、C分别跟D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子),而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下图所示的反应关系:
(1)写出下列物质的分子式:
甲__________,乙__________,丙__________,丁__________。
(2)写出反应①②③的化学方程式:
①_________________________________________________________。
②_________________________________________________________。
③_________________________________________________________。
下图的每一方格中表示有关的一种反应物或生成物,其中A、C、D、E为无色气体,F为红棕色气体。
试完成下列问题:
(1)M可以是____________,E是_____________,F是____________。
(2)反应①的化学方程式是________________________________。反应②的离子方程式是________________________。
(3)F与水的反应中氧化剂与还原剂的物质的量之比为____________。
(4)实验室检验C气体收集满了的方法是_______________________________,实验室检验A气体收集满了的方法是_________________________。