工业上生产硫酸的流程图如下: 
请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是 。
(2)在气体进入催化反应室前需净化的原因是 。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以 ,从而提高生产效率 。
(4)工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理: 。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是 。 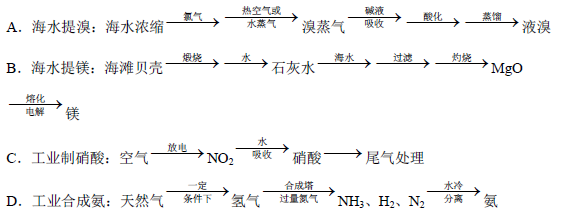
(1)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。
①写出Cl2与水反应的离子方程式 。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;从化学实验的安全环保角度考虑,你认为还应增加的装置是 。
(2)①如图所示,上述实验过程中,不会产生气体的是 ;
②写出反应D的化学方程式 。
(3)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
①食盐中加入碘化钾的碘损失率高的原因是 ;
②萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:
5KI+KIO3 + 6HCl =" 6KCl" + 3I2 + 3H2O,反应的现象是 。
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:

I II
(1)写出上述图中仪器的名称:① ;② ;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;实验时仪器②中冷却水的进口为 (选填“f”或“g”)。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是 , 。
比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如2Na2O2+2CO2 ="=" 2Na2CO3+O2,Na2O2+CO= Na2CO3。
(1)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(2)试分别写出Na2O2与SO2、SO3反应的化学方程式:_____________;_____________。
(3)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。试写出(CN)2与水反应的化学方程式:______________________________。
根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是 ,被氧化的是 元素。
(2)用双线桥法标出电子转移的方向与数目。
(3)该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为 。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物(Fe3I8),若该化合物中铁元素与碘元素的质量比_______,则反应Ⅱ的化学方程式是________________________________。
②操作A包括加热浓缩、______________、______________;用冰水洗涤的目的是______________。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①配平第一步反应的化学方程式:___H2O2+___I2→____HIO3+____H2O
②烹饪时,含KIO3的食盐常在出锅前加入,其原因是_______________________。
③若制得1.284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水__________kg。