现有X、Y、Z、M四种元素均为短周期元素。有关信息如下表:
(1)X元素在周期表中第_________周期、第_________族;
(2)Y元素的元素符号为_________,1个单质分子中含_________个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为_________ 。
(4)化合物X2M3中,各原子(或离子)最外层均达到8电子稳定结构,则X2M3的电子式为 _________,该化合物的水溶液在空气中久置后会被氧化而变质,生成一种单质,所得溶液呈强碱性。用化学方程式表示这个变化过程_________.
830K时,在密闭容器中发生下列可逆反应:
 CO(g)+H2O(g)
CO(g)+H2O(g) CO2(g)+H2(g);△H<0试回答下列问题:
CO2(g)+H2(g);△H<0试回答下列问题: (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=.
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=. (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)正)v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是。
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)正)v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是。 (3)若降低温度,该反应的K值将(均填“增大”“减小”或“不变”)。
(3)若降低温度,该反应的K值将(均填“增大”“减小”或“不变”)。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢(H2O2)。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
又知H2O(l)=H2O(g) ΔH=+44kJ/mol。
(1)写出过氧化氢(H2O2)的结构式。
(2)液态肼与液态过氧化氢反应生成液态水反应的热化学方程式为。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应: 2N2O5(g) ≒ 4NO2(g) + O2(g).△H﹥0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”、“不变”)。
(2)下表为反应在T1温度下的部分实验数据:
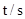 |
0 |
500 |
1000 |
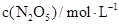 |
5.00 |
3.52 |
2.48 |
则,500s内N2O5的分解速率为_______________。
(3)在T2温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。则T2 __________ T1。(填“大于”“等于”或“小于”)
1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应并达平衡:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入Na2SO4_________________。②加入焦炭________________。
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,Na2SO4的转化率是_______________。
(3)若将容器温度升高20℃,H2在混合气体中含量变化用下图中_____图表示最合适。
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极,浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________