1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应并达平衡:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入Na2SO4_________________。②加入焦炭________________。
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,Na2SO4的转化率是_______________。
(3)若将容器温度升高20℃,H2在混合气体中含量变化用下图中_____ 图表示最合适。
(1)A元素原子核外M层电子数是L层电子数的一半,请写出
A元素基态时核外电子排布式:。
(2)B原子的最外层电子排布式为nsnnp2n,则B元素在元素周期表的中位置为第周期族。
(3)人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。那么硫原子的“未成对电子” 有个。
某有机物A的结构简式如图。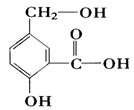
(1)1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是。
(2)1mol A与金属钠在一定条件下充分反应可生成标准状况下气体的体积为。
(3)A与NaHCO3溶液反应的化学方程式是: 。
(1)(CH3CH2)2C(CH3)2的名称为;
(2)2,6-二甲基-4-乙基辛烷的结构简式:。
(3)2-甲基-1,3-丁二烯的键线式为;
(4) 分子中含氧官能团的名称是;该有机物发生加聚反应后,所得产物的结构简式为。
分子中含氧官能团的名称是;该有机物发生加聚反应后,所得产物的结构简式为。
请根据题目要求回答下列问题:
(1)工业接触法制硫酸的生产中用到的设备有:①沸腾炉②,
③吸收塔,写出设备②中,发生的主要反应的化学方程式。
(2)已知SO2转化为SO3的反应为放热反应,下图中正确的是(填序号)。
(3)在吸收塔中,为了提高SO3的吸收率,工业上选择的吸收剂是(填序号)。
| A.H2O | B.稀H2SO4 |
| C.98.3%H2SO4 | D.NH3·H2O溶液 |
(4)在101Kpa时,燃烧1kg含FeS2质量分数为60%的黄铁矿,放出4265kJ的热量(假设杂质不参加反应),则表示FeS2燃烧热的热化学方程式为。
(6分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,溶液分层,下层呈紫红色;
(3)另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述碱性溶液加热,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实判断:在该溶液中肯定存在的离子是,肯定不存在的离子是,不能确定是否存在的离子是。