已知:2NO(g)+2CO(g)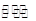 N2(g)+2CO2(g)
N2(g)+2CO2(g) 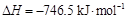 。请回答下列问题:
。请回答下列问题:
(1)对于气相反应,用某组分B的平衡分压p(B)代替平衡时物质B的物质的量浓度c(B)也可表示平衡常数,记作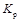 ,则该反应的平衡常数
,则该反应的平衡常数 。
。
(2)一定温度下,向密闭容器中充入一定量NO和CO。在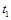 时刻达到平衡状态,此时
时刻达到平衡状态,此时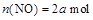 ,
,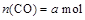 ,
, 。
。
①若保持体积不变,再向容器中充入a mol NO,2b mol CO2,则此时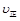
 (填“>”、“=”或“<”);
(填“>”、“=”或“<”);
②在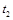 时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,
时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,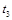 时刻达到新的平衡状态。请在下图甲中补充画出
时刻达到新的平衡状态。请在下图甲中补充画出 时段N2物质的量的变化曲线。
时段N2物质的量的变化曲线。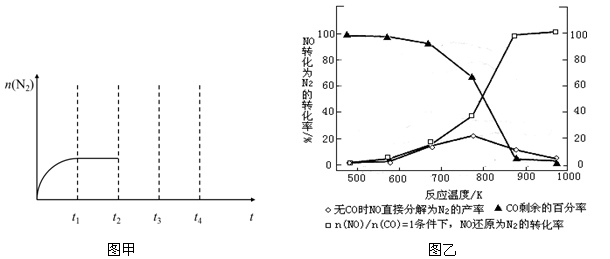
(3)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图乙所示。请判断若不使用CO,NO直接分解为N2的反应为 反应(填“放热”或“吸热”)。
(4)已知:①N2(g) + O2(g) 2NO(g)
2NO(g) 
②2C(s) + O2(g) 2CO(g)
2CO(g) 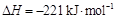
③2NO(g)+2CO(g)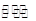 N2(g)+2CO2(g)
N2(g)+2CO2(g) 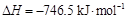
请写出表示C(s)的燃烧热的热化学方程式 。
请回答下列问题:
(1)写出铜元素基态原子的电子排布式,属于区
(2)写出配合物K3[Fe (SCN)6]中的中心离子为,配体为
(3)PCl3分子的空间构型为,中心原子成键时采取的杂化轨道类型为
(4)向盛有硫酸铜水溶液的试管中逐滴加入氨水至过量,实验现象是,有关反应的离子方程式为
“碘钟”实验中,3I—+ S2O32- = I3—+SO42-的反应速率可以用I3—与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I—)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O32-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.120 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是。
(2)显色时间t1=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)。
| A.<22s | B.22—44s | C.>44s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:___________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆(填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
分子式为C8H13O2Cl的有机物A发生如图所示的变化:
请回答下列问题:
(1)反应①和③的反应类型分别为:、
(2)请写出下列物质的结构简式:
B ; C
(3)请写出下列反应的化学方程式:
反应②
F与H等物质的量发生反应
(4)E与H通过缩聚反应生成的高分子化合物的结构简式为