科学家要研究跟碳元素及其化合物相关的很多课题。
(1)焦炭可用于制取水煤气。测得12g碳与水蒸气完全反应生成水煤气时,吸收了131. 6kJ热量,该反应的热化学方程式是_________ 。
(2)工业上可用焦炭冶炼金属,若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是_________。
(3)碳跟水蒸气制水煤气的反应是一个可逆反应,下列情况下能判断该反应一定达到平衡状态的是_________(选填编号.)。
| A.V正(H2O)=V正(H2) |
| B.容器中温度不再发生改变 |
| C.消耗nmolH2同时消耗nmolCO |
| D.容器中气体的总物质的量不随时间改变 |
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0molCO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应C(s)+H2O(g)  CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。
CO(g)+H2(g)的平衡常数的数值为_________。在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在下图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示)。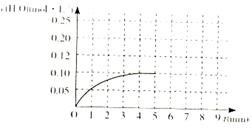
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
|
||||
 |
||||

| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入 NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
②请利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2
并进行有关实验。
①B中发生反应的化学方程式为 。
② 欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③ 试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
已知LiH、NaH及LiAlH4都是常见的金属的氢化物,其中LiAlH4可由下列途径合成:4LiH + AlCl3  LiAlH4+ 3LiCl。
LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是▲。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)正在载入...
镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为: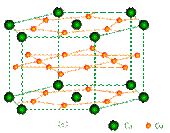
试回答下列问题
①在周期表中Ca处于周期表▲区。
②铜原子的基态核外电子排布式为:▲。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲(填数值);氢在合金中的密度为:▲。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。
有关说法正确的是▲。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时,储氢质量分数(wt%。)Ca32C60比Sr32C60高
盐酸西替利嗪在临床上广泛用于呼吸系统、皮肤和眼部过敏性疾病,它的一种合成路线如下: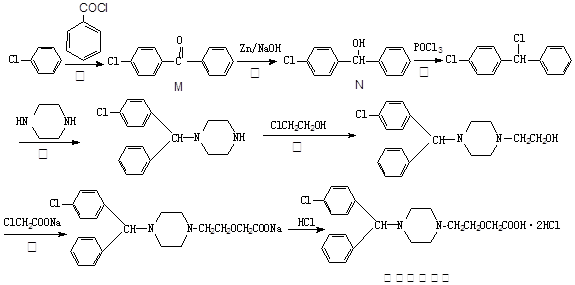 (1)上述反应中,属于取代反应的是 ▲(填序号).
(1)上述反应中,属于取代反应的是 ▲(填序号).
(2)物质M核磁共振氢谱有 ▲个峰。
(3)盐酸西替利嗪中含氧官能团是 ▲(写名称)。
(4)反应④中会产生一种含氮副产物,最有可能是 ▲。
(5)图中物质N符合下列条件的异构体有 ▲种。
①能与氯化铁溶液发生显色反应②含有-CH2Cl③含有联苯(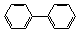 )结构。
)结构。
(6)抗血栓药氯吡格雷的手性合成如下: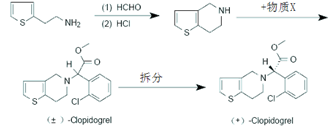
已知X的分子式为:C9H8Cl2O2,则X的结构式为 ▲。氯吡格雷中手性碳原子数目为▲个。
(7)已知: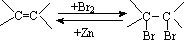
试以中药材大青叶的提取物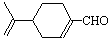 (紫苏醛)和甲醇为原料合成(紫苏
(紫苏醛)和甲醇为原料合成(紫苏
酸甲酯)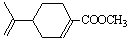 试写出合成路线。合成路线流程图示例如下:
试写出合成路线。合成路线流程图示例如下:
(8分)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是▲。
| A.停止使用氟里昂是为保护臭氧层 |
| B.光化学烟雾与大气臭氧的生成有关 |
| C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒 |
| D.臭氧能使湿润的碘化钾-淀粉试纸变蓝 |
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
用臭氧消毒自来水,适宜的条件是 ▲。
(3)2O3(g) →3O2(g) △H=-285kJ/mol, 2Ag2O(s) =" 4Ag(s)+" O2(g)△H="62.2" kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为: ▲。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式: ▲。
利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是
▲。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)= ▲
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是▲。与方法一相比,方法二的优点是 ▲。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
该反应的总化学方程式为 ▲。