铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g)ΔH=b kJ·mol-1
(1)反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
(2)Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________。
下图是元素周期表的一部分,其中所列字母分别代表某一元素
(1)写出元素k基态原子的核外电子排布式________________________。
(2)e、f单质及ef形成的合金的硬度由大到小的顺序为__________(用具体名称回答)。
(3)用来组成酸、碱、盐三类物质至少需要的元素有_________(用表中列出元素符号填写)。
(4)短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第___族。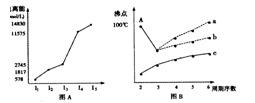
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第
族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:折线a和折线b,你认为正确的是。
惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。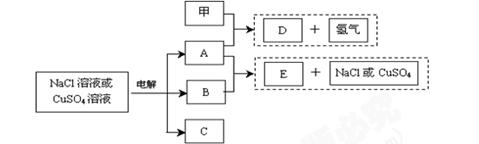
回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是 。
②A与B反应的离子方程式是 。
③若电解100mL0.1 mol·L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状
况),则所得溶液的pH为 (忽略反应前后溶液的体积变化及气体溶于
水的影响)。
(2)若电解的是CuSO4溶液:
①E的化学 式是;电解时阳极的电极反应式是 。
式是;电解时阳极的电极反应式是 。
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确
是。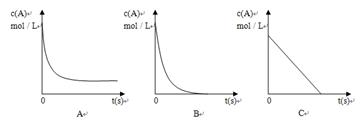
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为。已知Ksp(BaA)= 1.8×10-10,向该混合溶液中加入10mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(3)若溶液M由下列三种情况:①0.01mol·L-1的H2A溶液②0.01mol·L-1的NaHA溶液③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为_______;pH由大到小的顺序为_________________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配置CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,原因是,最后,他向烧杯中加入了一定量的溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn + CuSO4 =" Cu" + ZnSO4设计成的锌铜原电池。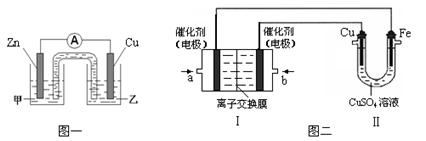
电解质溶液甲是(填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是(填“CH4”或“O2”),a处电极上发生的电极反应式是。
(3)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y=。
苯氯乙酮是一种具有荷花香味的有机物,其结构简式为: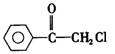 ,请回答下列问题:
,请回答下列问题:
(1)苯氯乙酮的分子式为 。
。
(2)苯氯乙酮可能发生的化学反应类型有(选填字母)。
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
(3)苯氯乙酮的同分异构体有多种,请写出同时符合下列三个条件的任意两种同分异构体的结构简式:
①分子内有苯环但不含甲基;②氯原子与链烃基直接相连;③能发生银镜反应。
、。
(4)已知:①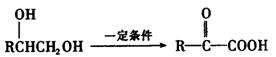
②通常状况下氯苯在氢氧化钠水溶液中不能发生水解反应。
苯氯乙酮的一种同分异构体M,可发生银镜反应,能用于合成杀菌剂F,F的结构简式是: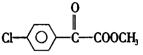 ,由M→F的转化关系如下:
,由M→F的转化关系如下: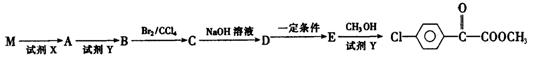
请回答:
①M的结构简式为,D中含氧官能团名称为。
②A→B的化学反应方程式为;
E→F 的化学反应方程式为。
③C与NaOH醇溶液反应,所得产物的分子式为C8H5C1,则该产物的结构简式
为。