科学家把药物连在高分子载体E上可制成缓释长效药剂。阿司匹林( 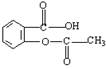 )
)
可连接在某高分子聚合物上,形成缓释长效药剂,其中一种结构简式为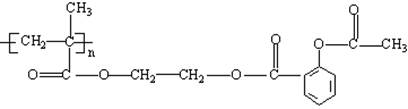
试回答:
(1)缓释长效阿司匹林的载体的结构简式__________________________________
(2)服药后,在人体内通过水解作用,可以缓慢地放出阿司匹林,写出这个水解反应的方程式__________________。
(3)这种高分子载体是由单体发生聚合反应而制得的,写出单体的结构简式_______________
Ⅰ.对某星球外层空间取回的气体样品分析如下:
①将样品溶于水,发现其主要成分气体A极易溶于水, 水溶液呈酸性;
②将A的浓溶液与KMnO4反应产生一种黄色气体单质B,将B通入石灰乳可生成两种钙盐的混合物D;
③A的稀溶液与锌粒反应生成气体C,C和B的气体充分混合经光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。
据此回答下列问题:
(1)化学式:A___________;C_____________;
(2)气体B与Ca(OH)2反应的化学方程式_______________________。
Ⅱ.双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N元素表现为-3价),化学方程式为:KCN+H2O+H2O2=KHCO3+A↑(已配平)
(3)生成物A的化学式为____________,该反应中的氧化剂____________;
(4)若将KCN改为HCN也类似上述反应,则该反应的化学方程式为____________。
Ⅰ.二氧化锰是化学工业中常用的氧化剂和催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s) MnO(s) + CO2(g)②2MnO(s) + O2(g)
MnO(s) + CO2(g)②2MnO(s) + O2(g)  2MnO2(s)
2MnO2(s)
(1)反应①达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 。(填字母序号)
| A.平衡常数减小 | B.MnCO3质量不变 | C.CO2压强不变 | D.MnCO3物质的量增加 |
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某温度下,该平衡体系的总压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,则碳酸锰热分解总反应的化学平衡常数Kp= (提示:用含P、n1、n2 的字母表达, 分压 = 总压×物质的量分数)
Ⅱ. 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液与烟气中SO2反应可制备MnSO4·H2O。
(4)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10‾39,pH =7.1时Mn(OH)2开始沉淀,pH =9.4时Mg(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+( 欲使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______________________。
(5)由右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 Ⅰ. 。Ⅲ. 二氧化锰也是电化学的重要材料。
(6)碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O ="=" 2MnOOH + Zn(OH)2,该电池正极的电极反应为 。
(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 |
溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 |
现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1。(忽略溶液体积变化)
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___________________________。

(3)臭氧也可用于烟气脱硝。
①O3氧化NO 结合水洗可产生HNO3和O2,该反应的化学方程式为______________。
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为___________。
(4)如图3是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为_____________。
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式: _____________________________。
(1)人们常用催化剂来选择反应进行的方向,左图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].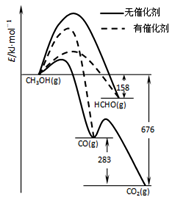
①写出1moLHCHO与O2发生反应时生成CO和H2O(g)的热化学方程式_______________;
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是_______________;
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g) 3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
A.混合气体密度保持不变 B.2v正(NO2)=3v逆(N2)
C.N2H4与NO2体积比保持不变 D.体系压强保持不变
②在某温度下,10L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 |
n(N2H4) |
n(NO2) |
n(N2) |
| 起始 |
2.0 |
3.0 |
0 |
| 第2min |
1.5 |
a |
0.75 |
| 第4min |
1.2 |
b |
1.2 |
| 第6min |
1.0 |
c |
1.5 |
| 第7min |
1.0 |
c |
1.5 |
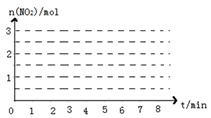
ⅰ前2min内NO2的平均反应速率为_____________(保留2位有效数字,下同)该温度下反应的平衡常数K=___________________。
ⅱ关于上述反应,下列叙述不正确的是_____________。
A.达到平衡时,移走部分N2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡向右移动,c(N2H4)将变大
C.在相同条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,应选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入He,则此时v(逆) >v(正)
ⅲ.请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图(在图上注明变化的条件)。