A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,相互转化关系如图所示: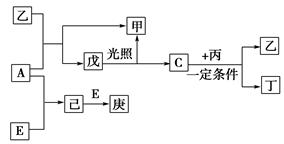
请回答下列问题:
(1)下面是周期表的一部分,请按A、C、E用元素符号填在相应的位置上。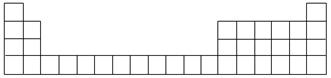
(2)写出工业上制取A反应的离子方程式:___________________________。
(3)戊的分子式为________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式:________________。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式为_______________________________。
(5)8 g E在A中燃烧放出热量Q kJ,写出该反应的热化学方程式:________________________________(热量是常温下测定的)。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: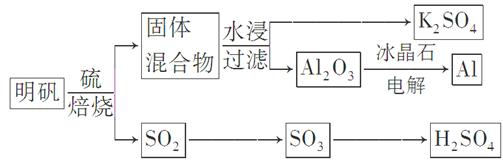 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是________。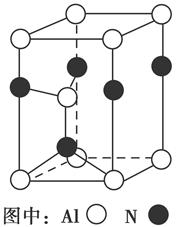
(3)Al2O3在一定条件下可制得AlN,其晶体结构如右图所示,该晶体中Al的配位数是________。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是________。焙烧948 t明矾(M=474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+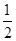 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。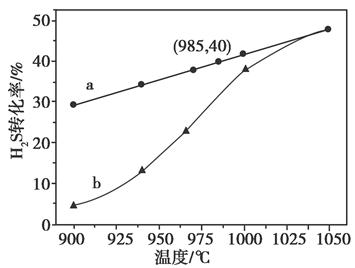
②电化学法
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是______________________________;
反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。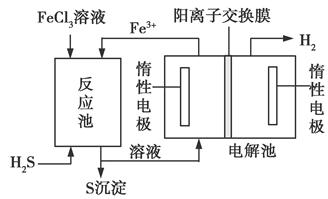
Fe(OH)3胶体在生活中有重要应用,利用FeCl3和沸水反应制备的Fe(OH)3胶体中常混有FeCl3和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
(1)实验室制取Fe(OH)3胶体的方法是________,用________方法除去胶体中的浑浊物;根据________现象证明胶体已经制成。
(2)检验溶液中存在Fe3+和H+的方法是__________________________________________
(3)除去胶体中混有的FeCl3和HCl的方法是:_________________________________。
(4)如何用实验的方法证明胶体和Cl-已经分离?___________________________。
(5)鉴别Fe(OH)3胶体和FeCl3溶液最简单的方法是_________________________________。
(6)高铁酸钠(Na2FeO4)的氧化性比KMnO4更强,它是一种备受关注的新型净水剂,请指出Na2FeO4净水的原理,并说明该净水剂有何优越性_______________________________________。
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是__。
(2)检验溶液B中是否存在Fe3+的方法是__。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
氨水物质的量浓度/(mol·L-1) |
盐酸物质的量浓度/(mol·L-1) |
混合溶液pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=__mol·L-1;从第②组情况表明,c__(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+)__(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序__>__>__>__(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小。
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在如图所示元素周期表(局部)中的相应位置上。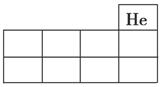
(2)X的最高价氧化物对应水化物的稀溶液与铜反应的化学方程式为。
(3)一定条件下,1 mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为__。
Ⅱ.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是__(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250 mol·L-1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。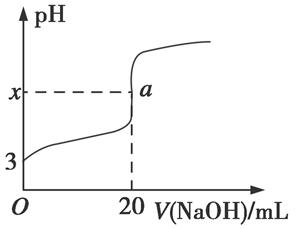
其中,a点表示两种物质恰好完全反应。
①图中x(填“>”“<”或“=”)7。
②室温时,HR的电离常数Ka=(填数值)。