臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)=3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):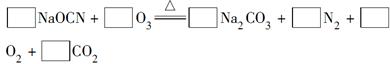
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如图所示:
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D,转化过程如下图所示。请回答相关相关问题:
(1)CH3COOOH称为过氧乙酸,写出它的一种用途。
(2)写出B+E→CH3COOOH+H2O的化学方程式。
(3)写出F可能的结构简式。
(4)写出A的结构简式。
(5)1摩尔C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比是。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:
。
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验。通过SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:____________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?_______________________________________________。
请简要说明两点理由:①_____________________________;② __________________。
一定温度下,把相对分子质量为M的可溶性盐W g溶解在V mL水中(水的密度为1 g·cm-3),恰好形成饱和溶液(密度为ρ g·cm-3),则溶质质量分数是______,物质的量浓度是_____________,该温度下此盐的溶解度是_____________。
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为,乙溶液的物质的量浓度为__________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是_____________________________。
向20mL盐酸和硫酸的混合酸溶液中,渐渐加入
0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算: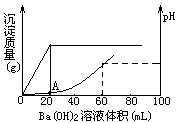
(1)原溶液中硫酸和盐酸的浓度各为多少_________________。
(2)A点处溶液的pH是______________。