2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成雾霾天气的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
据此判断:
①该反应是 反应(填“放热”或“吸热”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。 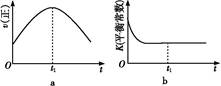

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g)ΔH="-867" kJ/mol
2NO2(g) N2O4(g) ΔH="-56.9" kJ/mol
N2O4(g) ΔH="-56.9" kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式: 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。 
③常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOO-平衡常数Kh= 。
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是。
(2)验证炉渣中含有FeO必要的化学试剂为。
(3)已知:生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀时 |
1.5 |
3.4 |
6.3 |
| 完全沉淀时 |
2.8 |
4.7 |
8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是。
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是。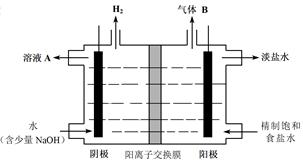
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是。
高分子化合物G是作为锂电池中Li+迁移的介质,合成G的流程如下:
已知:①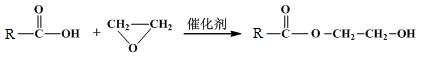
②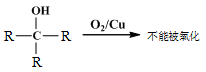
(1)B的含氧官能团名称是。
(2)A→B的反应类型是。
(3)C的结构简式是。
(4)D→E反应方程式是。
(5)G的结构简式是。
(6)D的一种同分异构体,能发生分子内酯化反应生成五元环状化合物,该同分异构体的结构简式是。
(7)已知:

M→N的化学方程式是。
(8)下列说法正确的是(填字母)。
a.E有顺反异构体
b.C能发生加成、消去反应
c.M既能与酸反应,又能与碱反应
d.苯酚与 C反应能形成高分子化合物
e.含有-OH和-COOH的D的同分异构体有2种
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为,气体单质D对应元素在周期表中的位置为。
(2)用化学方程式表示B溶液酸性增强的原因。
(3)气体A与NH3反应的化学方程式为,该反应体现气体A具有性。
(4)试写出制取气体A的化学方程式为。
(5)设计实验探究离子晶体C的成分为。
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是;工业上制取A的离子方程式。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:。