某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: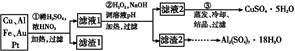
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: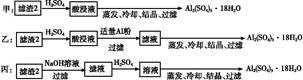
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
以海水中常见物质A为原料可以发展很多工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题。
(1) C和D、C和G反应都可以制取消毒剂。C和D反应制取的消毒剂中有效成分的化学式为______ ____。
(2) 电解A溶液反应的离子方程式为________________________________。
(3) 将F和J通入A的饱和溶液中,反应的化学方程式为:
________________________________。
(4) J的空间构型为___________形。
(5)实验室可利用K与G制取J,请写出该反应化学方程式:______________________________________________________。
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,c为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则该反应的反应方程式为:_____ ______
检验D中阴离子所用试剂为:
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出C溶液呈强碱性时反应的离子方程式:
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的物质的化学式(写两种):,。
水是生命之源,也是化学反应中的主角。试回答下列问题:
A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),
它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出
A.B.C与水反应的化学方程式:
(1) _____ _______
(2)
(3) 。
(14分) (1)322g Na2SO4·10H2O的物质的量是________,其中所含的Na+的物质的量是,所含H2O分子的数目是个;将322gNa2SO4·10H2O溶于水配成2L溶液,其物质的量浓度是_______ 。
(2)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为mol。
②该气体在标准状况下的体积为L。
③该气体溶于水后形成V L溶液,其溶液的物质的量浓度为mol/L
现有下列两组物质:①H2、CaCO3、HCl、NH3 ②氯化钠溶液、硫酸铜溶液、氢氧化铁胶体、硫酸铁溶液。请你从组成的元素、 物质的性质等多个角度用两种不同的分类标准从每组中选出一种不同类的物质,并指出其分类依据,写在下面相应的表格内。
物质的性质等多个角度用两种不同的分类标准从每组中选出一种不同类的物质,并指出其分类依据,写在下面相应的表格内。
| 组别 |
被选出的物质 |
分类依据 |
第①组 |
||
第②组 |
||