用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)。
①Cl2 ②H2O2 ③HNO3 ④KMnO4
(2)要得到较纯的产品,试剂B可选用 。
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)从滤液经过结晶得到氯化铜的方法是 (按实验先后顺序填编号)。
①过滤 ②冷却 ③蒸发浓缩 ④蒸发至干
(4)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体,加入足量10%的氢氧化钠溶液、过滤、洗涤后用小火加热至质量不再减轻为止,冷却、称量所得固体的质量为n g。
①方案一中灼烧CuCl2·xH2O得到无水CuCl2,应在 (填仪器名称)中进行。
方案二中配制一定量10%的氢氧化钠溶液,其操作步骤是计算、称量、 。
②试评价上述两种实验方案,其中可行的方案是 ,另一种方案不可行的理由是 ,若用方案二,计算得x= (用含m、n的代数式表示)。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是 ,负极发生的电极反应方程式为: 。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为 mol。
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(3)下图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为 。
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为 ,A的官能团为 (填名称)。
(2)下列物质中,不能通过乙烯加成反应得到的是 (填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
(3)已知2CH3CHO+O2 2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示: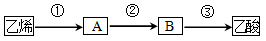
a.反应②的化学方程式为 。
b.工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是 。
已知四种元素A、B、C、D,其原子序数依次增大,最外层电子数依次为4、1、2、7,其中A元素原子次外层电子数为2,B、C 两元素的原子次外层电子数为8,B元素原子最外层电子数比第1层电子数少1,也比C元素原子第M层电子数少1,D元素的单质为液态非金属单质。若此四种元素均位于元素周期表前四个周期,请按要求填写下列各题:
(1)A原子的原子结构示意图为 ,D元素在元素周期表中的位置为 。
(2)B元素的最高价氧化物对应的水化物用电子式表示为 ,C、D两元素形成的化合物化学键类型为 。
(3)请写出D元素的单质与SO2同时通入水中反应的化学方程式: 。
海水是资源的宝库,海水淡化可获得淡水和浓海水。浓海水中主要含有的离子有Na+、 Mg2+、Cl﹣、SO42﹣。从浓海水中提取金属镁的一段工艺流程如图所示: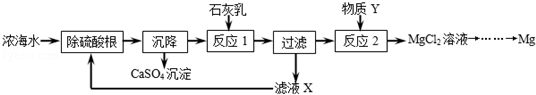
(1)补全由贝壳(主要成分为碳酸钙)生产石灰乳的相应转化中所需的条件或反应物: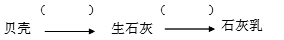
(2)写出反应2的化学方程式:____________________。
(3)操作流程中可循环使用的物质是___________(填化学式)。
周末同学们乘坐地铁去参观中国地质博物馆。
(1)乘坐地铁时需要进行安检,有哪些物品禁止携带?请举例说明。_____________(列举两种即可) 。
(2)来到博物馆门口,在地质学家李四光的大理石雕像前,同学们了解他的生平事迹。大理石的主要成分是___________(写化学式)。
(3)同学们进入博物馆,看到了许多矿石标本,其中的4种矿石及其主要成分如下:
①根据辉铜矿的主要成分,有同学推测以辉铜矿为原料,可制得含铜元素或含硫元素的产品,他的依据是______________。
②在学校同学们学习过用一氧化碳和赤铁矿炼铁,请用化学方程式表示炼铁的原理:___________。