下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径(nm) |
0.102 |
0.110 |
0.117 |
0.074 |
0.075 |
0.071 |
0.099 |
0.077 |
| 最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是________________;
(2)C和H的气态氢化物的稳定性强弱关系为______________(用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_____________________________________。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3===2________+CO2
横线上某盐的化学式应为________。
(5)在一密闭容器中发生反应2AD2+D2 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。在下列方框内绘出该实验方案装置图。
(6分) 一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
回答下列问题:
(1)化合物Ⅲ生成化合物Ⅳ的副产物为_____________。(提示:原子利用率100%,即原子全部都转化成产物)
(2)CH2=CH2与溴水反应方程式:__________________________________.
(3)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:
_____________________________________________________________。
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是
| A.化合物Ⅲ可以发生氧化反应 |
| B.化合物Ⅲ不可以与NaOH 溶液反应 |
| C.化合物Ⅳ能与氢气发生加成反应 |
| D.化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气 |
E.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
F.化合物Ⅴ可以发生水解反应
(5分) 请观察下图装置,回答下列问题: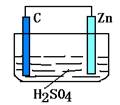
(1) 负极是________,发生_______反应(填氧化或还原)
(2) 正极是________,发生_______反应(填氧化或还原)
(3) 正极的电极反应式:__________________________.
(4分)( 1)为了检验和除去下表中的各种杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒精(水) |
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 ( II)除杂试剂:a.硫酸 b.酸性高锰酸钾溶液 c.新制的生石灰 d.溴水 |
(5分) 有W、X、Y、Z四种短周期元素,它们的核电荷数依次增大; W元素原子是所有原子中半径最小的; X元素原子L层电子数是K层电子数的3倍, Y元素原子的最外层电子数与电子层数相同;Z元素原子的最外层电子数比次外层少1。由此可知:
(1)写出它们的元素符号W_______X______Y_______Z________.
(2)X在元素周期表中的位置是 _________。
某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜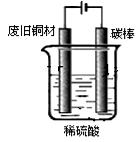
装置如图,写出阳极发生的电极反应式、。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 |
开始沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式。
(2)步骤②中可加入(填化学式)调节溶液pH至(填范围)。
(3)步骤③不能蒸干的原因是。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是。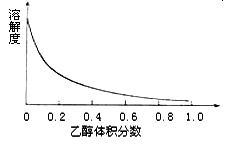
| A.无水乙醇 | B.蒸馏水 |
| C.95%乙醇溶液 | D.饱和硫酸钠溶液 |
(5)操作1的名称是。