研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1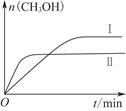
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO2、3 mol H2 |
a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的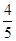 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下: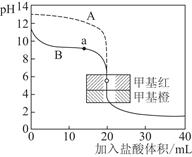
请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
(1)按要求在下列空格中填出下列有机物的有关式子:
相对分子质量最小的有机物电子式,食醋中的有机物结构式,糖尿病患者尿液中含的糖类结构简式。
(2).下面列出了几组物质,请将物质的合适组号填写在空格上。
同位素,同系物,同分异构体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦ 和CH3CH2CH2CH2CH3⑧ C(CH3) 4 和
和CH3CH2CH2CH2CH3⑧ C(CH3) 4 和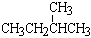
已知在强碱溶液中加热R-Br 容易水解为R-OH,现知某芳香烃A有如下转化关系: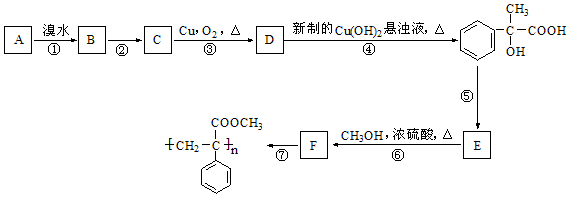
按要求填空:
(1)写出反应②和⑤的反应条件:② ;⑤
(2)写出A和F结构简式:A ;F
(3)写出反应①和⑥的类型:① ;⑥
(4)写出反应③、⑦对应的化学方程式:
③
⑦
新合成的一种烃,其碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式。
(2)该烃的一氯取代物是否有同分异构体。
(3)该烃的二氯取代物有多少种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或溴水溶液褪色,但在一定条件下能跟溴发生取代反应、与H2发生加成反应,这种同分异构体的结构简式是。
已知乙烯能发生以下转化: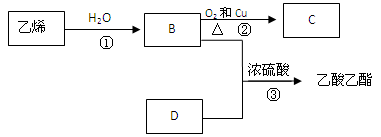
(1)乙烯的结构简式为: 、空间构型为___________.
(2)写出B、D化合物中官能团:B中含官能团;D中含官能团;
(3)写出反应的化学方程式
①反应类型:
②反应类型:
Ⅰ、已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是:。
Ⅱ、在铜片、锌片和400 mL稀硫酸组成的原电池中,若电路中通过0.2 mol电子,H2SO4恰好反应完毕。试计算:
(1)生成气体的体积(在标准状况下);
(2)原400 mL稀硫酸的物质的量浓度(不考虑溶液的体积变化)。