利用碳-碳偶联反应合成新物质是有机合成的研究热点之一,如:
化合物Ⅰ可以由以下合成路线获得:
(1)化合物Ⅰ的分子式为__________________。
(2)化合物Ⅱ与溴的CCl4溶液发生加成反应,产物的结构简式为______________________。
(3)化合物Ⅲ生成化合物Ⅰ的化学方程式为_____________;(注明反应条件)化合物Ⅲ与NaOH水溶液共热的化学方程式为_____________。(注明反应条件)
(4)化合物Ⅳ是化合物Ⅲ的一种同分异构体,其苯环上只有一种取代基,Ⅳ的催化氧化产物Ⅴ能发生银镜反应。Ⅳ的结构简式为_____________,Ⅴ的结构简式为_____________。
(5)有机物 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为____________________。
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为____________________。
某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HC l(浓)、KCl,其中Cl2、H2O均为生成物。
l(浓)、KCl,其中Cl2、H2O均为生成物。
(1)该反应中的氧化剂是 ,氧化产物为 。
(2)该反应中,氧化产物与还原产物的物质的量之比为。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程 中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
(4)购买的浓盐酸(密度为1.19g/cm3)在工业上是用HCl气体(标准状况)与H2O按体积比500:1配制成的,则该盐酸的物质的量浓度是 mol/L(结果保留一位小数)。
咖啡酸(见下),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。
(1)咖啡酸的化学式是其中含氧官能团的名称为、。
(2)咖啡酸可以发生的反应是(填写序号)。
①水解反应 ②加成反应 ③酯化反应 ④消去反应
(3)1mol咖啡酸与浓溴水反应时最多消耗mol Br2。
(4)咖啡酸与NaHCO3溶液反应的方程式
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、SiO2的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: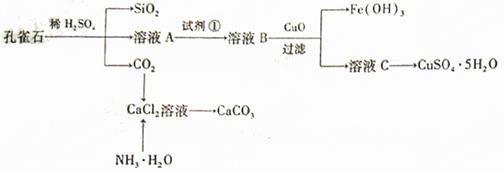
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(3)制备CaCO3时,应向CaCl2溶液中先通入,然后再通入 (填化学式)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应。用KMnO4标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)图中A表示,E的大小对该反应的反应热有无影响?。 (2)合成氨反应N2(g)+3H2(g)
(2)合成氨反应N2(g)+3H2(g)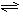 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂,反应的ΔH(填“增大”“减小”或“不改变”)。如果反应速率v(H2)为0.15 mol·L—1·min—1,则v(NH3)=mol·L—1·min—1
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂,反应的ΔH(填“增大”“减小”或“不改变”)。如果反应速率v(H2)为0.15 mol·L—1·min—1,则v(NH3)=mol·L—1·min—1 (3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”)。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”)。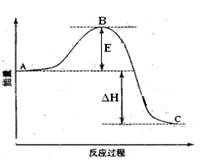
常温下,已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合后,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是(填“强酸”或“弱酸”)
(2)0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中,
c(IO3-)c(Na+)(填“大于”、“小于”或“等于”)。
(3)已知某溶液中只存在OH-、H+ 、IO4- 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
| A.c(Na+)>c(IO4-)>c(OH-)>c(H+) | B.c(IO4-)>c(Na+)>c(OH-)>c(H+) |
| C.c(Na+)>c(OH-)>c(IO4-)>c(H+) | D.c(IO4-)>c(Na+)>c(H+)>c(OH-) |
填写下列空白:
①若溶液中只有一种溶质,则该溶质是,上述四种离子浓度大小顺序为
(填选项的标号)
②若上述关系中C项是正确的,则溶液中的溶质有、