已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为______。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为________
在该晶体中,E4+的氧配为数为____________。若该晶胞边长为a nm可 计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)

已知乳酸的结构简式为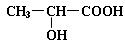 。试回答:
。试回答:
(1)乳酸分子中含有和两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式为
(3)乳酸与Na2CO3溶液反应的化学方程式为
(4)当乳酸和浓硫酸共热时,能产生多种酯类化合物,任意写出两种该类产物的结构简式、
某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示: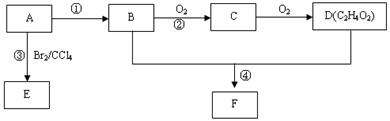

 (1)A的结构式为,B中官能团的电子式为,
(1)A的结构式为,B中官能团的电子式为, D中官能团的名称为。
D中官能团的名称为。 (2)反应①的反应类型是,
(2)反应①的反应类型是,
反应③的化学方程式为 。
。
 (3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次。该反应的化学方程式为。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次。该反应的化学方程式为。 (4)D与碳酸氢钠溶液反应的离子方程式为。
(4)D与碳酸氢钠溶液反应的离子方程式为。 (5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
 试管1中装入药品后加热。图中X的化学式为。
试管1中装入药品后加热。图中X的化学式为。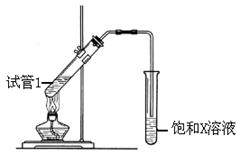
 其作用是。
其作用是。 试管1反应的化学方程式为。
试管1反应的化学方程式为。
某结晶水合物中有 两种阳离子和一种阴离子,所含元素均为短周期元素,为确定组成,某同学进行如下实验:称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
两种阳离子和一种阴离子,所含元素均为短周期元素,为确定组成,某同学进行如下实验:称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
(1)该结晶水合物中含有的两种阳离子是 __和 __,阴离子是。
(2)试通过计算确定该结晶水合物的化学式。
3)假设过 程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
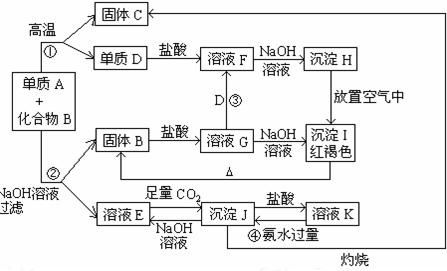
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在FeCl2___(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4___(填“是”或“否”),你的判断依据是
 。
。
⑶写出反应④的离子反应式: 。
。
⑷请根据计算结果判断混合物中是否含有Al Cl3(说出你的计算依据,不要求写计算过程)
Cl3(说出你的计算依据,不要求写计算过程)
。
⑸把AlCl3溶液中加热浓缩 蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶?
蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶?
。
由单质A和化合物B两种粉末组成的混合物,在一定条件下可按下页框图所示关系进行转化:
请回答:
(1) A、B的化学式分别是_____________________、_____________________。
(2) 写出反应①的化学反应方程式___________ __________。
__________。
(3)写出反应②、③的离子方程式②_________ ____________;
____________;
③___________________。
(4)若要保存F溶液,应采取什么措施?;
为什么? _____________________。