化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)“三酸”与“两碱”之间均可反应,酸过量时, 若用化学方程式表示有六个,若用离子方程式表示却只有两个,一个是H++OH-=H2O,请写出另一个离子方程式: 。
(2) 实验室制备H2、CO2、NH3、SO2时,用盐酸和稀硫酸可制备的相同气体是_______。
(3)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
① ;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,再将溶液蒸干,最终得到固体的质量为 g。
(5)利用侯德榜制碱法可制两碱的一种,请写出制取小苏打时在溶液中发生反应的总化学方程式 。
有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中C的名称是______▲__________;
(2)画出B元素原子的结构示意图________▲________ ;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式______▲______ ____ ;
____ ;
A的氢氧化物和D的氢氧化物反应的离子方程式_________▲_______ 。
分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下: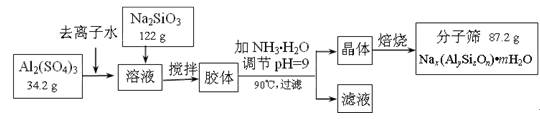
|
 成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
 ▲ (写化学式)。
▲ (写化学式)。
 分子筛。
分子筛。
(12分)
雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al ▲Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: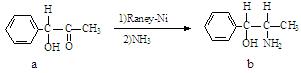
化合物b中进行sp3杂化的原子有: ▲。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: ▲(选填序号)。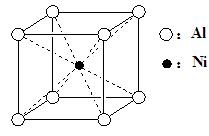
a.氯化钠b.氯化铯c.石英d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: ▲。
②在配合物中用 化学键和氢键标出未画出的作用力(镍的配位数为4)。
化学键和氢键标出未画出的作用力(镍的配位数为4)。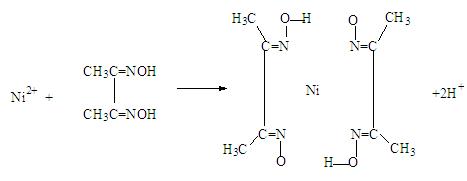
β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下: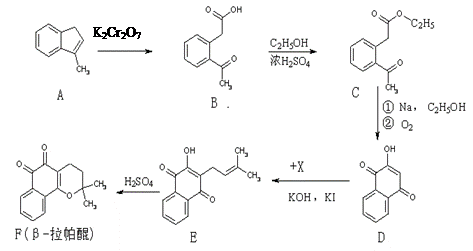
(1)已知X的分子式为C5H9Cl,则X的结构简式为: ▲。
(2)反应类型A→B ▲。
(3)上述反应中,原子利用率达100%的是 ▲(选填:“A→B”、“B→C”、“D→E”、“E→F”)。
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为: ▲。
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有 ▲种(不包括立体异构)。
①属于苯的衍生物②苯环上有两个取代基
③分子中含有一个手性碳原子④分子中有一个醛基和一个羧基
(6)已知:双烯合成反应: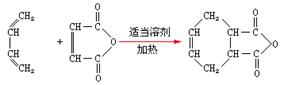 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子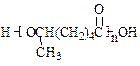 。
。
[提示]合成路线流程图示例如下: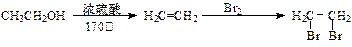
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法在酸性介质中 用FeSO4等将+6价铬还原成+3价铬。
用FeSO4等将+6价铬还原成+3价铬。
具体流程如下: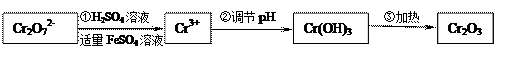
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0[ |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 ▲。
▲。
(2)还原+6价铬还可选用以下的 ▲试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为: ▲(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 ▲(填序号)最佳。
A.3~4  B.6~8 C.10~11 D.12~14
B.6~8 C.10~11 D.12~14
[方法二]电解法将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极 的电极反应式 ▲。
的电极反应式 ▲。
(5)电解法中加入氯化钠的作用是: ▲。