开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“="”" );
②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。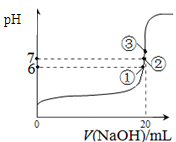
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与 其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置,,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:。
(2)D、F的气态氢化物,沸点较高的是(填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14, 充分作用后,溶液pH7(填“>”“<”或“=”),原因是
充分作用后,溶液pH7(填“>”“<”或“=”),原因是 。
。
(12分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: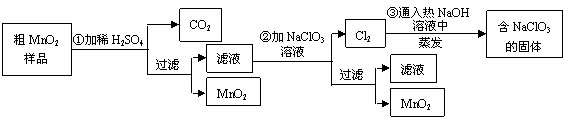
(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式 +
+ ClO3-+
ClO3-+ =
= MnO2+
MnO2+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要mol NaClO3
有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为;
1 L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+NH4+Al3+K+ |
| 可能大量含有的阴离子 |
Cl-Br-I‑ClO‑AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(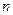 )与加入NaOH溶液的体积(
)与加入NaOH溶液的体积(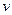 )的关系如右图所示。
)的关系如右图所示。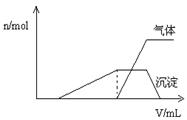
则该溶液中确定含有的离子有;
不能确定是否含有的阳离子有,
要确定其存在可补充做的实验是;
肯定不存在的阴离子有。
(2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
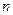 (Cl-) (Cl-) |
1.25mol |
1.5 mol |
2 mol |
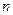 (Br-) (Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
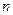 (I-) (I-) |
 mol mol |
0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为。
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是双原子分子形成的单质,C、E是化合物。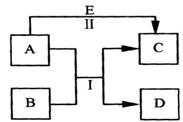
(1)若A是气态单质,其水溶液具有漂白性,D在常温下为固态。E是一种可溶性强碱,其焰色反应为黄色。则
①A、C的化学键类型分别为,;
②写出C的一种用途;
③写出A+B→C+D反应的化学方程式。
(2)若A是金属单质,D是无色气体,E是A的盐溶液。则
①D的化学式是
②A和E发生反应的离子方程式为。