决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号) 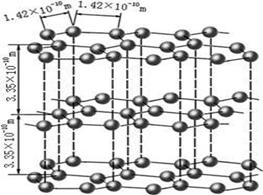
Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合) 

图Ⅰ 图Ⅱ 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)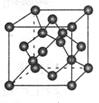
(共10分)下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最强的单质是,还原性最强的单质是;
(2)最高价氧化物的水化物中碱性最强的是,酸性最强的是,呈两性的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.最小的是。
(10分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: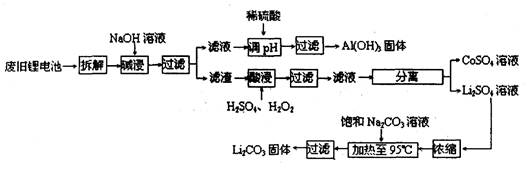
(1)上述工艺回收到的产物有
(2)Li原子的最外层电子数是,废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是___________________________________________
(3)碱浸时主要反应的化学方程式为。
(4)最后一步过滤应趁热过滤,原因是
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。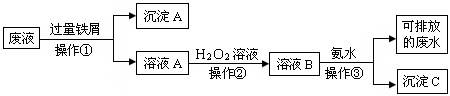
(1)操作①的名称是。
(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是。
(3)操作②中发生反应的离子方程式为。
(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4·7H2O)的实验方案。
(一)铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,但在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
(二)有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,设计实验证明矿物样品中有Fe3+。
实验用品:研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
(4)简述实验操作步骤、现象和结论。
(7分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了mol H2SO4,生成L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为:(写出序号)
① 浓H2SO4②稀H2SO4③CuSO4