煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: 
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
砷(As)广泛分布与自然界,砷与氮同主族,比氮多两个电子层。
(1)砷位于元素周期表中_____周期________族,其气态氢化物的稳定性比NH3_______(填“强”或“弱”);
(2)砷的常见酸性氧化物有As2O3和As2O5,请根据图中信息写出As2O3分解为As2O5的热化学方程式:________________________;
(3)已知:将酸滴入砷酸盐与KI混合的溶液中发生反应:AsO43-+2I―+2H+=AsO33-+I2+H2O.某研究性学习小组同学欲利用该反应原理,设计实验装置探究原电池原理,请你配合他们绘制原电池装置图,并回答下列问题:
若以石墨为电极,正极上发生的反应为______________.该电池工作时,当外电路中转移5mol电子时,则有_________molI2生成.
工业制氢气的一个重要反应是:CO(g)+H2O(g)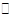 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
①C(石墨)+1/2O2(g)=CO(g)△H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g)△H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-242kJ·mol-1
则反应CO(g)+H2O(g) ="==" CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: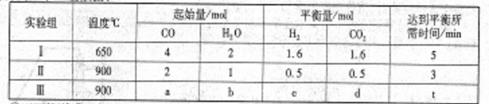
①以下反应能说明CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
| A.容器中CO的含量保持不变 | B.容器中CO2浓度与CO浓度相等 |
C.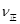 (CO)= (CO)=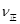 (H2O) (H2O) |
D.容器中混合气体的平均相对分子质量保持不变 |
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率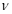 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时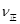 ___________
___________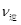 (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
废旧锂离子电池的正极材料(主要含有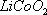 及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
及少量Al、Fe等)可用于回收钴、锂,实验方法如下: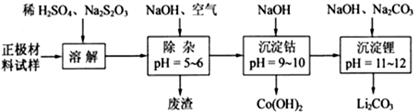
已知:Fe3+开始沉淀pH="2.7," 完全沉淀pH="3.2;" Al3+开始沉淀pH="3.8," 完全沉淀pH="5.2;" Co2+完全沉淀pH=9.15
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为,氧化剂是_________________________________。
(2)在上述除杂过程中,通入空气的作用是_____________________。通入空气和加入NaOH溶液后发生的离子方程式是______________废渣的主要成分是Al (OH)3和_______________。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为_________________、_________________。
(4)该工艺可回收的副产品是_________________________(写化学式)。
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
1/4CaSO4(s)+CO(g) ⇋ 1/4CaS(s)+CO2(g)∆H1 = -47.3kJ∙mol-1
② CaSO4(s)+CO(g) ⇋ CaO(s)+CO2(g) +SO2(g)∆H2 = +210.5kJ∙mol-1
③ CO(g) ⇋ 1/2C(s)+1/2CO2(g)∆H3 = -86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g) ⇋ CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)
的∆H=__________(用∆H1、∆H2和∆H3表示)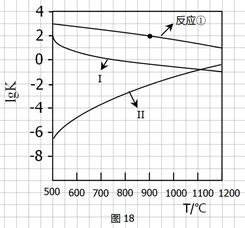
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,回答下列问题。a)曲线中对应反应②的是_______(选填“Ⅰ”或“Ⅱ”)。
归纳lgK-T曲线变化规律: b)_________________。
c)________。
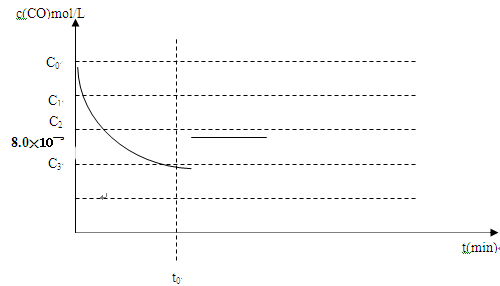
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol∙L-1的CO,反应①于900℃
达到平衡,此时c平衡(CO)=8.0X10-5 mol∙L-1。
d)用图18中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字)。
e) c(CO)随反应时间t的变化曲线如图19所示。
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应)。
化合物G的合成路线如下: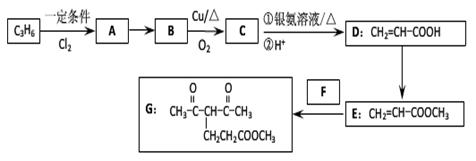
(1)D中含氧官能团的名称为,1 molG发生加成反应最多消耗mol H2。
(2)去掉E中含有少量D的试剂和操作是;下列有关E的说法正确的是(填字母序号)。
| A.可发生氧化反应 | B.催化条件下可发生缩聚反应 |
| C.可发生取代反应 | D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式:
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为。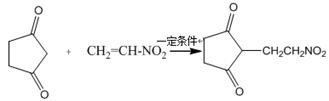
(5)比G少2个氢原子的物质具有下列性质:任写一种该物质的结构简式。
①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗2mol Na和1mol NaOH。