工业制氢气的一个重要反应是:CO(g)+H2O(g)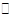 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
①C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) ="==" CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: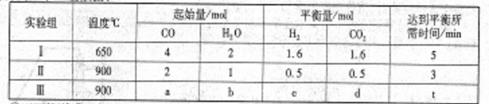
①以下反应能说明CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
| A.容器中CO的含量保持不变 | B.容器中CO2浓度与CO浓度相等 |
C.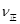 (CO)= (CO)=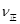 (H2O) (H2O) |
D.容器中混合气体的平均相对分子质量保持不变 |
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率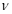 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时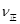 ___________
___________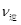 (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
短周期元素X、Y、Z在周期表中位置关系如图:(答题时,X、Y、Z用所对应的元素符号表示)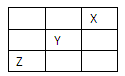
(1)x元素的单质分子式是_______,单质是_______晶体。
(2)自然界中存在一种仅含钙与Y两种元素的天然矿物,其电子式为_______,属于_______晶体。
(3)Z的氢化物和Y的氢化物沸点高低顺序是:,理由:
。
(4)X、Y、Z三种元素中,电负性最大的是:。
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1mol NaHCO3能完全反应,则A的结构简式是,写出与A具有相同官能团的A的所有同分异构体的结构简式
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是
⑶某有机物完全燃烧,生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4g。
①若有机物的质量为4.6g,此有机物的分子式为
②若有机物的质量为6.2g,且此有机物lmol能和足量的金属钠反应生成lmolH2,此有机物的结构简式为(两个羟基不能连在同一个碳原子上)
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C―比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A元素的名称是_______;
(2)C―的结构示意图为;D元素在周期表中的位置是__________;
(3)元素D的气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_______,若反应中有0.25mol氧化铁参加反应反应中转移电子的个数为__________;
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材
料是_______(用化学式填写),负极电极反应是___________________________________。
现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。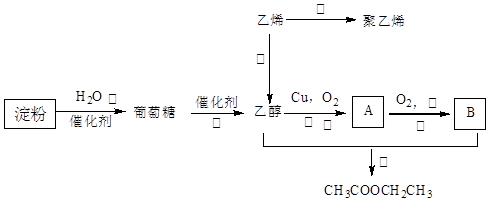
(1)A中含有的官能团名称是;其中⑥的反应类型是;
(2)写出下列反应的化学方程式:①
③
⑤
(3)另一同学用葡萄糖和冰醋酸反应,若C6H12O6与CH3COOH的分子个数比为1:1,则生成的有机物可能有种。请任写一种产物的结构简式:。
(4)用乙酸乙酯和H218O反应制取乙醇时原子的最大利用率为
(10分)某离子晶体的晶胞结构如图所示,试求:
(1)晶体中每一个Y同时吸引着______个X,每个X同时吸引着________个Y,该晶体的化学式是________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)设该晶体的摩尔质量为M g·mol-1,晶胞密度为ρ g·cm-3,阿伏加德罗常数为NA·mol-1,则晶体中两个最近的X中心间距离为________ cm。