将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压 强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/mol· L-1 |
2.4× 10-3 |
3.4× 10-3 |
4.8× 10-3 |
6.8× 10-3 |
9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
在反应4Mg+10HNO3(稀) ====4Mg(NO3)2+NH4NO3+3H2O中,氧化剂是__________,还原剂是_____________,氧化产物是_____________,还原产物是_____________。1 mol Mg转移了________________mol电子,1 mol HNO3参加反应,有__________mol HNO3被还原,得到__________mol电子。
配平下列氧化还原反应方程式
Cu2++FeS2+ ====Cu2S+
====Cu2S+ +Fe2++
+Fe2++
配平□P4O+□Cl2——□POCl3+□P2Cl5。
配平方程式:
□SO2+□H2S——□S+□H2S
一个体重50 kg的健康人含铁2 g。这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子(亚铁离子)易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可以使食物中的铁离子(三价铁离子)变成亚铁离子,有利于铁的吸收。
(1)人体中经常进行Fe2+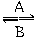 Fe3+的转化,A中Fe2+作_________剂,B中Fe3+作_______剂。
Fe3+的转化,A中Fe2+作_________剂,B中Fe3+作_______剂。
(2)从“服用维生素C,可以使食物中的铁离子变成亚铁离子”这句话分析出维生素C在这一反应中作______________剂,具有_________________性。