某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。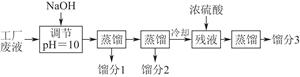
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
| 物质 |
丙酮 |
乙酸乙酯 |
乙醇 |
乙酸 |
| 沸点(℃) |
56.2 |
77.06 |
78 |
117.9 |
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。
(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010 mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。
(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗
某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。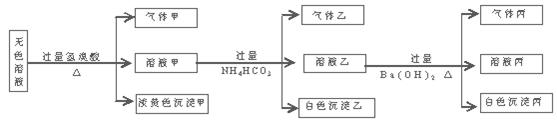
试回答下列问题:
(1)生成沉淀甲的离子方程式为
(2)由溶液甲生成沉淀乙的离子方程式
(3)沉淀丙可能是;
如何用一化学实验来确定其成分
(4)综合上述信息,可以肯定存在的离子有
一定不存在的离子是
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 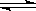 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂反应的△H(填“增大” “减小” 或“不改变”)。
(2)已知:O2 (g)=O2+(g)+e-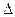 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1
PtF6(g)+ e-==PtF6-(g)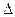 H2=" —771.1" kJ·mol-1
H2=" —771.1" kJ·mol-1
O2+PtF6-(S)=O2+ (g)+ PtF6-(g)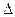 H3=" 482.2" kJ·mol-1
H3=" 482.2" kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(S)的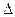 H=kJ·mol-1。
H=kJ·mol-1。
(3)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显性(填“酸”“碱”或“中”);用含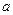 的代数式表示NH3·H2O的电离常数Kb=。
的代数式表示NH3·H2O的电离常数Kb=。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各小题:
(1)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=。
(用上图中出现的字母表示)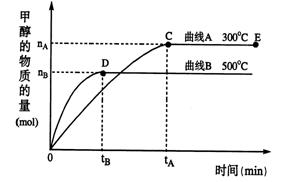
(2)在其他条件 不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是。
不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为C u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
(4)能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22. 7kJ的能量,写出甲醇燃烧热的热化学方程式。
回答下列问题:
(1) 常温下,pH=5的盐酸和pH=9的氢氧化钠溶液按体积比9∶11混合,混合后溶液的pH为
(2)NH4Cl溶液显酸性,试用离子方程式 表示这一反应_____________________。
表示这一反应_____________________。
(3)已知水的电离方程式可写为2H2O  H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式________________________;在液氨中加入NH4Cl,则平衡将向________移动(填“正反应方向”或“逆反应方向”)。
H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式________________________;在液氨中加入NH4Cl,则平衡将向________移动(填“正反应方向”或“逆反应方向”)。
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(选填“>”、“<”或“=”);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m________n(选填“>”、“<”或“=”)。
(18分)如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。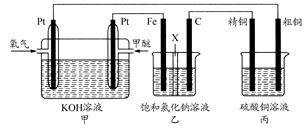
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式___________________
 _____________________________________。
_____________________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或 “石墨极”)区
“石墨极”)区
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成 的气体的分子数为________;丙装置中阴极析出铜的质量为_______
的气体的分子数为________;丙装置中阴极析出铜的质量为_______ _。
_。