在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 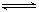 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: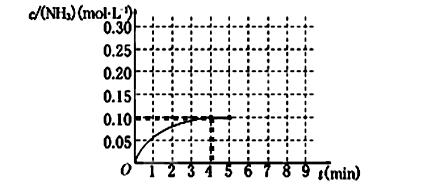
(1)根据上图,计算从反应开始到平衡时,氢气的平均反应速率v(H2)为______________。
(2)该反应达到平衡时N2的转化率_________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________。(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>”、“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、、可制得精盐。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下: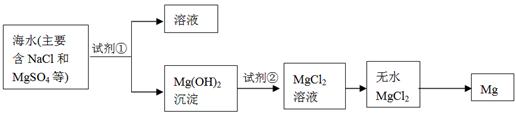
①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用,要使MgSO4完全转化为沉淀,加入试剂①的量应;
②试剂②可以选用;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是。
A. |
B. |
C.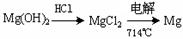 |
D.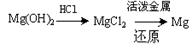 |
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下: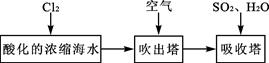
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示);
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是;
④C装置的作用是。
有机化学知识在生活中应用广泛 。
。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
①下列有关说法中,正确的是;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上。写出
葡萄糖发生银镜反应的化学方程式:。
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为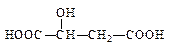 ,该分子中官能团的名称为,可以和醇类物质发生反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为。
,该分子中官能团的名称为,可以和醇类物质发生反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为。
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)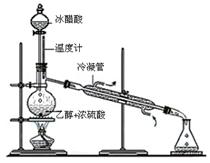
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号);
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程 图。
图。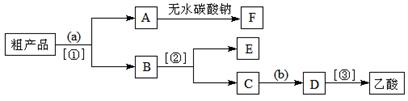
试剂a是,分离方法①是;分离方法②是,试剂b 是;
是;
④写出C → D 反应的化学方程式。
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl =" NaCl" + H2O,
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A.B.。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是(填“锌”或“铜”),发生反应(填“氧化”或“还原”);
②正极的电极反应式为;
③产生这些气体共需转移电子mol。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
有三个电子层,K、M层电子数之和等于L层电子数 |
| B |
短周期中金属性最强 |
| C |
常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)用化学用语回答下列问题:
①A元素在周期表中的位置;
②B元素原子结构示意图;
③C单质分子的电子式;用电子式表示A和B元素组成的化合物的形成过程;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素。
(2)元 素D与元素A相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号)。
素D与元素A相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是(写化学式)。
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去)。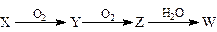
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:;生成该白色沉淀的化学方程式为;
② 若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:。
若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:。
(8分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。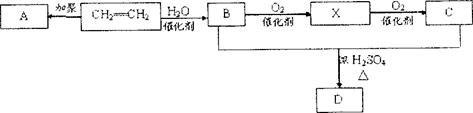
据此回答下列问题。
(1)写出乙烯的一种用途,指出乙烯 B的反应类型。
B的反应类型。
(2)写出A的结构简式。
(3)写出X和新制的氢氧化铜悬浊液反应的化学方程式。
(4)写出B+C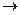 D的化学反应方程式。
D的化学反应方程式。