学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学反应。
(1) 明矾[KAl(SO4)2]是一种盐。其在水中的电离方程式是 ,明矾的用途是 。
(2)微粒32X2- 核外有18个电子,则它的核电荷数为 ,核内中子数为 。
(3)工业上用铝粉还原一些金属氧化物,这类反应称为铝热反应。写出在高温下铝还原氧化铁的化学方程式_______________________________________,在反应中消耗2mol铝,则转移了_________mol电子
(4)用氢氧化铝治疗胃酸过多的离子方程式:
(5)工业生产漂白粉的化学方程式
(10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为,浓度是mol·L-1;由②可知存在的离子为,浓度是mol·L-1;由③可知存在的离子为,浓度是mol·L-1。
(2)该溶液中一定不存在的离子是(填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是。
有一在空气中暴露过的KOH固体,经分析含H2O 2.8%,K2CO3 7.2%,取1g该样品投入25ml浓度为2mol/L的盐酸中,中和多余的盐酸又用去1.0mol/L的KOH溶液30.0ml,将中和后的溶液蒸干,所得固体的质量为
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
(1)上述离子中属于金属元素的是________(填元素符号),与非金属原子相对应的离子的结构示意图是______。
(2)电子层结构相同的是__________(填序号,下同),性质最稳定的是________,最容易失去电子的是________,最容易得到电子的是______________。
(3)可直接相互结合形成的化合物的化学式是__________,可经过得失电子后再相互结合形成的化合物的化学式是_____________。
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。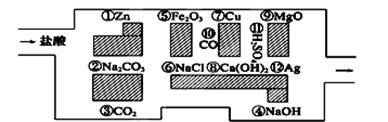
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)____________。
(2)在能“吃掉”盐酸的化学反应中,其中能“吃掉”盐酸的盐是_______________(填化学式),写出该反应的化学方程式_______________________________________________。
(3)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
________________________________________________________________________。
现有下列物质:①氯酸钾 ②硫酸铜 ③二氧化硅 ④镁 ⑤氧气 ⑥氢氧化钠
⑦硫酸 ⑧甲烷请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于有机物的是(填序号)。
(2)属于电解质的有(填序号),依次写出其电离方程式:
(3)从上述物质中选出1种或2种为反应物,按下列反应类型各写1个化学方程式:
①化合反应 ;
②分解反应;
③置换反应 ;
④复分解反应。