环境污染中除了有害气体产生的空气污染外,重金属离子在溶液中引起的水体污染也相当严重.近年来城市汽车拥有量呈较快增长趋势,汽车尾气的主要有害成分一氧化碳和氮氧化物加重了城市空气污染.研究NO2、SO2、CO等大气污染气体的处理及研究重金属离子水污染的处理具有非常重要的意义.
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体.将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,若测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= .
(2)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例).
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3=2NaNO2+CO2;2NO2+Na2CO3=NaNO2+NaNO3+CO2
用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 .
(3)如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的 极(选填“正”或“负”).写出B极电极反应式 .
 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 .
(5)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示.则B点时剩余固体的成分是 (填化学式).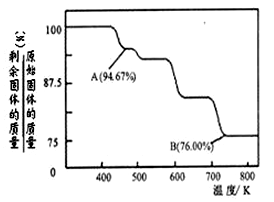
阿魏酸在食品、医药等方面有着广泛用途。由A(分子式C3H6C12)合成阿魏酸的流程如下图所示: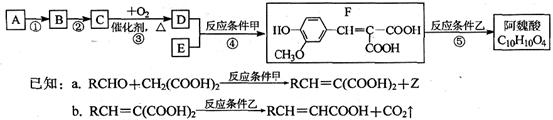
(1)上述反应a中,生成物Z的化学式为。
(2)阿魏酸的结构简式为。
(3)写出下列反应的化学方程式:
反应①:,
C与足量新制Cu(OH)2共热:。
(4)有同学提出:可用酸性KMnO4溶液检测反应④中是否有F生成,该说法是否正确?,
说明理由:。
(5)E有多种同分异构体,写出同时符合下列要求的所有E的同分异构体结构简式:
①既能发生银镜反应,又能与FeCl3溶液发生显色反应
②苯环上的一氯代物只有一种。
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为;
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应: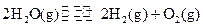
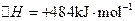 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
(2)已知: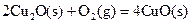 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1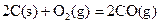 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为。
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为;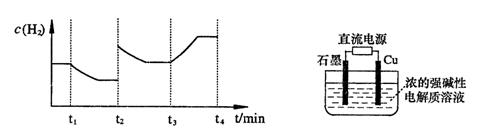
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
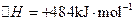 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
(2)已知: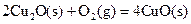 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1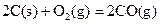 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为。
已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:
(1)反应①阳极的电极反应式。
(2)反应③的化学方程式,
(3)反应④的离子方程式为。
(4)K是一种难溶于水的固体,K受热分解可生成H。实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
A.NaOH溶液B.氨水 C.Na2CO3溶液D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
该液体接通直流电后___ __极附近颜色加深,这种过程叫做____ _。
(6)若E中含有合金元素,会导致G不纯。测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。(杂质不参与反应) 则样品中G的质量分数为: 。
则样品中G的质量分数为: 。
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。 Ⅰ.MnFe2O4的制备:
Ⅰ.MnFe2O4的制备:


 已知Fe3+、Mn2+沉淀的pH为下表所示。
已知Fe3+、Mn2+沉淀的pH为下表所示。
 (1)此工艺中理论
(1)此工艺中理论 上投入原料Fe(NO3)3和Mn(NO3)2
上投入原料Fe(NO3)3和Mn(NO3)2 的物质的量之比应为。
的物质的量之比应为。 (2)步骤二中b的值为。
(2)步骤二中b的值为。 (3)步骤三中洗涤干净的标准是。
(3)步骤三中洗涤干净的标准是。 Ⅱ.用MnFe2O4热化学循环制氢:
Ⅱ.用MnFe2O4热化学循环制氢: MnFe2O4(s)→MnFe2O(
MnFe2O4(s)→MnFe2O( 4-x)(s) +
4-x)(s) +  O2(g);△H1
O2(g);△H1 MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2 请回答下列问题:
请回答下列问题: (4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为
(4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为 。
。 (5)该热化学循环制氢的优点有(填序号)。
(5)该热化学循环制氢的优点有(填序号)。 A.过程简单、无污染 B.物料可循环使用
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
C.氧气和氢气在不同步骤生成,安全且易分离 (6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3 则:△H3与△H1、△H2的关系为△H3=。
则:△H3与△H1、△H2的关系为△H3=。